【佳学基因检测】细胞周期蛋白依赖性激酶与人类乳腺癌的基因检测指导下的靶向药物治疗
靶向药物基因检测导读
细胞周期蛋白依赖性激酶 (CDK) 是丝氨酸/苏氨酸激酶,其催化活性受与细胞周期蛋白和 CDK 抑制剂 (CKI) 相互作用的调节。CDK 是通过调节细胞周期检查点和响应细胞外和细胞内信号的转录事件参与细胞增殖的关键调节酶。毫不奇怪,CDKs 的失调是癌症的标志,抑制特定成员被认为是癌症治疗的一个有吸引力的目标。在乳腺癌 (BC) 中,双重 CDK4/6 抑制剂 帕博西尼、瑞博西尼 和 玻玛西尼 联合其他药物最近被美国食品药品监督管理局 (FDA) 批准用于治疗激素受体阳性 (HR+) 晚期或转移性乳腺癌 (A/MBC) 以及其他亚型乳腺癌。此外,正在进行的研究确定了更具选择性的 CDK 抑制剂作为有希望的临床靶点。在这篇综述中,肿瘤靶向药物基因检测的应用研究组关注 CDK 在驱动细胞周期进程、细胞周期检查点和转录调控中的作用,这是 BC 中 CDK 活化失调的一个亮点。肿瘤靶向药物基因检测的应用研究组还讨论了目前在临床 BC 试验中最相关的 CDK 抑制剂,特别强调用于治疗雌激素受体阳性 (ER+)/人表皮生长因子 2 阴性 (HER2-) M/ABC 患者的 CDK4/6 抑制剂,以及更多新兴的精准治疗策略,如联合疗法和 microRNA (miRNA) 疗法。BC 中 CDK 活化失调的一个亮点。肿瘤靶向药物基因检测的应用研究组还讨论了目前在临床 BC 试验中最相关的 CDK 抑制剂,特别强调用于治疗雌激素受体阳性 (ER+)/人表皮生长因子 2 阴性 (HER2-) M/ABC 患者的 CDK4/6 抑制剂,以及更多新兴的精准治疗策略,如联合疗法和 microRNA (miRNA) 疗法。BC 中 CDK 活化失调的一个亮点。肿瘤靶向药物基因检测的应用研究组还讨论了目前在临床 BC 试验中最相关的 CDK 抑制剂,特别强调用于治疗雌激素受体阳性 (ER+)/人表皮生长因子 2 阴性 (HER2-) M/ABC 患者的 CDK4/6 抑制剂,以及更多新兴的精准治疗策略,如联合疗法和 microRNA (miRNA) 疗法。
靶向药物基因检测关键词
乳腺癌(BC),细胞周期蛋白依赖性激酶(CDK),CDK抑制剂,细胞周期,临床治疗
1、乳腺癌及其靶向药物治疗背景知识
乳腺癌 (BC) 是癌症患者死亡的主要原因之一,根据综合内在基因表达谱分为五种主要亚型:管腔 A(雌激素受体 (ER) 和/或孕激素受体 (PR) -阳性,和人表皮生长因子受体 2 (HER2)-阴性),luminal B(ER-或 PR-阳性和 HER2-阳性),基底样(ER-、PR-和 HER2-阴性,细胞角蛋白 5/ 6 阳性和/或表皮生长因子受体 (EGFR) 阳性,75% 的三阴性乳腺癌 (三阴性乳腺癌)(ER-、PR- 和 HER2 阴性)共享基础标志物表达),HER2 型(ER 阴性、PR 阴性和 HER2 阳性)和正常样。这些 BC 亚型基于特定的形态学模式、生物学特性、不同的临床阶段和预后进行表征。大约 77% 的 BC 患者为受体阳性,靶向治疗已被证明有效。不幸的是,大约 15%–25% 的 三阴性乳腺癌 患者由于无法进行靶向治疗而表现不佳。三阴性乳腺癌 和大多数 BC 患者通常建议手术联合化疗和放疗。迫切需要早期诊断、精确治疗和预后,以改善预后、预防癌症进展和开发有效的治疗方法。目前,细胞周期调节的作用是此类发现的一个引人入胜的领域。
哺乳动物细胞分裂和死亡是组织稳态中两个主要的主要生理过程。细胞周期过程高度保守且精确控制以控制基因组复制和细胞周期,由四个不同的有序阶段组成,称为 G0/G1(间隙 1)、S(DNA 合成)、G2(间隙 2)和 M (有丝分裂)和多个检查点,以确保在 S 期忠实复制和染色体精确聚集到子细胞中。G1和G2期是关键的调节检查点,G1和S期之间的限制点决定了细胞是进入S期还是退出细胞周期停止在G0期。细胞周期由许多细胞周期蛋白和细胞周期蛋白依赖性激酶 (CDK) 调节,它们是一组丝氨酸/苏氨酸激酶。它们与细胞周期蛋白形成复合物,以在特定阶段稳定、激活和磷酸化 CDK。细胞周期蛋白/CDKs 的形成通过靶基因的磷酸化来控制细胞周期进程,例如肿瘤抑制蛋白视网膜母细胞瘤 (Rb)。细胞周期蛋白/CDKs 的激活是由有丝分裂信号诱导的,并由响应 DNA 损伤的细胞周期检查点的激活来抑制。细胞周期蛋白/CDKs 本身受到细胞周期蛋白依赖性激酶抑制剂 (CKI) 的负调控,例如 CDK4 (INK4) 蛋白抑制剂(p16 INK4a、p15 INK4b、p18 INK4c和 p19 INK4d)和 CDK 相互作用蛋白/激酶抑制蛋白 (CIP/KIP) (p21 CIP1、p27 KIP1和 p57 Kip2 )。此外,E3 泛素连接酶还参与调节许多有丝分裂蛋白的表达以影响细胞周期的转变,例如 Skp1-Cul1-F-box-蛋白 (SCF) 复合物和后期促进复合物/环体 (APC) /C)。细胞周期的失调和细胞周期调节蛋白的基因改变导致许多实体癌类型的细胞增殖失控,包括 BC,这是设计 CDKs 合成抑制剂作为抗癌药物的生物医学研究的前沿。在这篇综述中,肿瘤靶向药物基因检测的应用研究组关注 CDK 在细胞周期调控和基因转录中的作用,并提供 CDK 抑制剂作为 BC 临床应用的潜在靶点。
2.细胞周期和转录中的 CDK
CDK 响应细胞外和细胞内信号以调节细胞分裂,通过与作为调节亚基的细胞周期蛋白形成异二聚体复合物来充当催化亚基。在人体细胞中,有 20 个 CDK 和 29 个 cyclin。CDK1、CDK2、CDK3、CDK4、CDK6 和 CDK7 直接调节细胞周期转换和细胞分裂,而 CDK7-11 介导基因转录。CDK 的表达在整个细胞周期中呈周期性波动。
2.1 CDK 在细胞周期中的作用
在大多数成人组织中,大多数具有二倍体 DNA 含量的细胞都处于静止 G0 状态,该状态可以是短暂的(静止)或永久的(终末分化或衰老)。如图所示图1,在有丝分裂时,静止细胞通过有丝分裂因子(激素或生长因子)的刺激参与重新进入细胞周期。这些因子汇聚在细胞周期上,激活影响 CDK4 和 CDK6 的细胞内信号网络级联,从而驱动细胞周期从 G0 或 G1 期进入 S 期。CDK4/6 的活性受与 D 型细胞周期蛋白(细胞周期蛋白 D1、细胞周期蛋白 D2 和细胞周期蛋白 D3)的结合正控制,并通过与 INK4 家族的 CDK 抑制剂(p16 INK4A、p15 INKB、p18 INK4C、和 p19 INK4D )。然后,活性细胞周期蛋白 D/CDK4/6 复合物启动肿瘤抑制蛋白 RB(由 RB1 编码)以及密切相关的蛋白 p107(也称为 RBL1)和 p130(也称为 RBL2)的磷酸化。RB蛋白最初招募共抑制因子并抑制由E2F转录因子(E2Fs)调节的靶基因的转录以抑制G1/S转换。通过这种方式,使RB活性失活的顺序磷酸化导致细胞周期从G1期进入S期。同时,磷酸化的 RB 去抑制 E2F 转录因子并诱导 G1/S 靶基因的转录,如细胞周期蛋白 E (CCNE)、CCNA 和 CCNB、二氢叶酸还原酶 (DHFR)、核糖核苷酸还原酶 M1 (RRM1) 和 RRM2 和 polo -样激酶 1 (PLK1)、纺锤体检查点蛋白 MAD2 (MAD2)。在 G1 后期,E2F 的靶基因(细胞周期蛋白 E1 和 E2)被激活,从而结合并激活 CDK2,CDK2 最初被两种 CDK 抑制剂 p21 CIP1和 p27 KIP1隔离,以及泛素介导的 p27 KIP1和p21 CIP1。此外,细胞分裂周期 25A (CDC25A) 通过去除 CDK2 的磷酸化来激活 CDK2。此外,活性 CDK2 能够磷酸化细胞周期进程所需的范围相当广泛的底物谱蛋白(例如 p27 KIP1、RB 和 E2F1)、DNA 复制(例如复制因子 A 和 C)、中心体复制(例如核磷蛋白 (NPM))和组蛋白合成(例如核蛋白、组蛋白转录辅激活因子 (NPAT) )。具体来说,cyclin E/CDK2活性复合物调节RB超越边界处G1/S期的限制点,导致S期启动,形成正反馈回路。CDK4/6 和 CDK2 的活性协调细胞周期进入 S 期,称为“限制点”,因此不再需要有丝分裂原来完成当前的细胞周期。在 S 期末期,cyclin A 去除 cyclin E 并形成一个新的复合物 cyclin A/CDK2,其中 cyclin E 被 F-box/WD 重复蛋白 7 (FBXW7) 介导的泛素化快速降解。cyclin A/CDK2 复合物通过磷酸化 CDC6 和 E2F1 来终止 S 期,并驱动细胞周期从 S 期过渡到 G2 期,随后通过 cyclin A 激活 CDK1,导致细胞进入过渡到 M 期。有丝分裂后,CDK1 的活性由复合细胞周期蛋白 B/CDK1 维持。活化的CDK1的磷酸化导致核膜破裂、染色体凝聚和有丝分裂纺锤体的组装。有丝分裂中期至后期由纺锤体组装检查点 (SAC) 控制,后期依赖于 CDK1 通过 APC/C 降解细胞周期蛋白 B 降低的活性。CDK1 的失调表达使染色体分离和有丝分裂和胞质分裂的完成。CDK1 是唯一对细胞周期进程至关重要的 CDK,因为它启动有丝分裂的开始并确保关键事件以高保真度的细胞复制中的确切顺序发生。除了由其细胞周期蛋白伙伴调节外,CDK1 的活性还受 WEE1 G2 检查点激酶 (WEE1)、膜相关酪氨酸和苏氨酸特异性 cdc2 抑制激酶髓磷脂转录因子 1 (MYT1,称为 PKMYT1),以及 CDC25C 磷酸酶的磷酸化。WEE1 在 Tyr 15 处磷酸化 CDK1,而 MYT1 在 Thr 14 和 Tyr 15 处磷酸化以抑制 CDK1 的活性,并且这种磷酸化被 CDC25C 磷酸酶解除。另一方面,cyclin C/CDK3磷酸化RB,将细胞从G0期推入S期。细胞退出细胞周期并进入可逆或永久的 G0 期,也受细胞周期蛋白 C/CDK3 的调节。
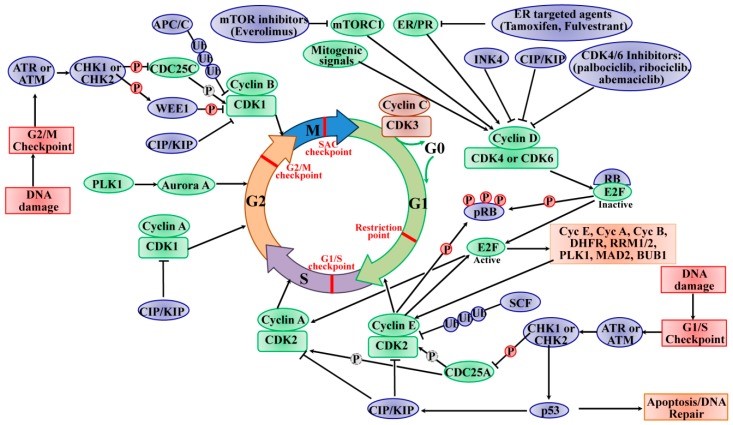
图1:细胞周期的进程及其对 CDK 和检查点的调节((2020 Mar 13. doi: 10.3390/ijms21061960)
细胞周期的进程及其对 CDK 和检查点的调节。细胞周期受许多 CDK 调节,这些 CDK 与其相关的细胞周期蛋白伴侣形成复合物。细胞周期由细胞周期的四个不同的有序阶段组成,称为 G0/G1、S、G2 和 M 阶段,它包含多个检查点(红色),以防止基因组不稳定,并确保忠实复制。细胞退出细胞周期,进入由cyclin C/CDK3调控的可逆或永久静止状态(G0期)。各种细胞外信号,例如有丝分裂信号,导致细胞周期蛋白 D 的合成并刺激 CDK4/6,从而促进进入细胞周期。活性 CDK4/6 复合物启动 RB 蛋白的磷酸化 (P),从而释放 E2F 转录因子,导致细胞周期蛋白 E、细胞周期蛋白 A、细胞周期蛋白 B 和 S 期进展所需的许多基因的表达。Cyclin E 随后激活 CDK2 并有助于进一步磷酸化 RB,进入 S 期,并启动 DNA 合成。在 S 期快结束时,cyclin A 去除 cyclin E 并形成一个新的复合物 cyclin A/CDK2。Cyclin A/CDK2 通过磷酸化 CDC6 和 E2F1 来终止 S 期;它驱动细胞周期从S期过渡到G2期,随后通过cyclin A激活CDK1,导致细胞进入M期。有丝分裂后,CDK1 活性由复合细胞周期蛋白 B/CDK1 维持。CDK1 的失调使染色体分离和有丝分裂和胞质分裂的完成。INK4、CIP/KIP 和 CDK4/6 抑制剂(帕博西尼、瑞博西尼 和 玻玛西尼)抑制 CDK/cyclin 的活性。细胞周期蛋白的泛素化 (Ub) 参与调节许多蛋白质的表达以控制 CDK 的循环活性,例如 SCF 和 APC/C。PLK1 和极光 A 蛋白参与 S 期和从 G2 期到 M 期的进展。此外,DNA 损伤检查点保护基因组完整性并通过检查点激酶 2 (CHK2) 和 G1 期的 p53 或通过 S 或 G2 期的 CHK1 触发细胞周期停滞。虚线圆圈中的 P 表示去磷酸化。绿色椭圆表示正调节剂,蓝色椭圆表示细胞周期进程的负调节剂。(改编自参考“PLK1 和极光 A 蛋白参与 S 期和从 G2 期到 M 期的进展。此外,DNA 损伤检查点保护基因组完整性并通过检查点激酶 2 (CHK2) 和 G1 期的 p53 或通过 S 或 G2 期的 CHK1 触发细胞周期停滞。虚线圆圈中的 P 表示去磷酸化。绿色椭圆表示正调节剂,蓝色椭圆表示细胞周期进程的负调节剂。(改编自参考“PLK1 和极光 A 蛋白参与 S 期和从 G2 期到 M 期的进展。此外,DNA 损伤检查点保护基因组完整性并通过检查点激酶 2 (CHK2) 和 G1 期的 p53 或通过 S 或 G2 期的 CHK1 触发细胞周期停滞。虚线圆圈中的 P 表示去磷酸化。绿色椭圆表示正调节剂,蓝色椭圆表示细胞周期进程的负调节剂。(改编自参考“绿色椭圆表示正调节剂,蓝色椭圆表示细胞周期进程的负调节剂。
细胞周期被 DNA 损伤介导的细胞周期检查点阻止或阻断,从而允许在细胞周期进展为有丝分裂之前进行 DNA 修复。如图所示图1,两个主要的细胞周期检查点对 DNA 损伤有反应;它们发生在 G1 和 G2 阶段的 DNA 合成前后,并影响特定 CDK 复合物的活性。检查点激酶磷脂酰肌醇 3 激酶 (PI3K) 样蛋白激酶 (PI3KKs) 共济失调毛细血管扩张症和 Rad3 相关 (ATR) 或共济失调毛细血管扩张症突变 (ATM) 蛋白,以及传感器检查点激酶 CHK1(由 CHEK1 基因编码)和 CHK2 (由 CHEK2 基因编码)是 DNA 损伤信号传导的关键调节因子。DNA 损伤信号由 ATM/ATR 检测,然后分别磷酸化和激活 CHK2/CHK1。激活的 CHK2 参与 p53 的激活,导致依赖 p53 的早期 G1 期阻滞,从而为 DNA 修复留出时间。p53 的激活诱导 CKI p21 CIP1基因的表达,导致细胞周期蛋白 E/CDK2 复合物的抑制和 DNA 修复机制的下游上调。如果 DNA 修复无法成功完成或细胞无法编程以应对活细胞周期停滞的压力,则细胞将面临由 p53 诱导的细胞凋亡的命运。活化的 CHK1 通过磷酸化介导暂时的 S 期阻滞,使 CDC25A 失活,导致泛素化和蛋白水解。此外,活化的 CHK1 磷酸化并使 CDC25C 失活,导致细胞周期停滞在 G2 期。活性 CHK1 还直接刺激 WEE1 的磷酸化,从而增强 CDK2 和 CDK1 的抑制性 Tyr15 磷酸化,并随后在 G2 期阻断细胞周期。G2 细胞周期阶段的低水平 CDK 活性也可刺激 WEE1 的活性。SAC,也称为有丝分裂检查点,用作监测中期染色体与有丝分裂纺锤体的正确附着,受 TTK 蛋白激酶 (TTK,也称为单极纺锤体 1 (MPS1)) 的调节。SAC 的激活通过抑制 APC/C 的激活瞬时诱导细胞周期停滞。为了建立和维持有丝分裂检查点,TTK 在有丝分裂期间通过磷酸化其底物将许多检查点蛋白募集到动粒,以确保足够的染色体分离和基因组完整性。通过这种方式,染色体分离缺陷导致的基因组不稳定性受到 SAC 的保护。一旦 SAC 通过,APC/C E3 连接酶复合物会刺激并标记细胞周期蛋白 B 和 securin 以进行泛素介导的降解,从而引发有丝分裂。总之,检查点提供了一种故障保护机制,以确保从亲代细胞到子代细胞的基因组完整性。检查点激活的信号转导级联最终收敛于 CDK 抑制,这表明 CDK 功能是细胞周期进程的关键驱动因素。
2.2. CDK 在转录中的作用
在哺乳动物中,信使 RNA (mRNA) 的产生受到严格调控,在 RNA 聚合酶 II (RNAPII) 的催化下分为起始、暂停、延伸和终止的离散阶段,RNA 聚合酶 II (RNAPII) 由最大亚基 (Rpb1) 组成具有进化上保守的七肽 (Tyr–Ser–Pro–Thr–Ser–Pro–Ser)的 C 末端结构域 (CTD) 重复序列。CTD 在 RNA 加工和染色质组织中起着至关重要的作用,通过改变其磷酸化水平来协调转录和共转录事件。Tyr1、Ser2、Thr4、Ser5 和 Ser7 在七肽中被多个 CDK/细胞周期蛋白亚基磷酸化,例如 CDK1 或 CDK2 以及大多数转录 CDK,例如 CDK7、CDK8 和 CDK9 亚家族。。CTD-RNAPII 的 Ser5 和 Ser7 磷酸化是启动子转录起始所必需的。当起始转录发生时,Ser5 磷酸化水平降低,而 Ser2 和 Tyr1 磷酸化增加以促进转录延伸。在转录终止期间,Tyr1 首先被去磷酸化,紧随其后的是 Ser5、Ser7 和 Ser2,这允许重新启动转录周期。
主动转录由启动子识别和 DNA 解旋启动,从而形成启动前复合物。如图所示图 2, 一个非常复杂的过程需要 RNAPII 与大的多亚基介导复合物和几种通用转录因子相互作用, 它是由转录因子 II D (TFIID) 的 TATA 结合蛋白与核心启动子的结合引发的, 形成前-起始复合体(PIC)。CDK8 或 CDK19 与 C 型细胞周期蛋白相关,它们是介体复合激酶模块 (MED) 的一部分,充当分子桥梁,将来自 DNA 结合转录因子的基因特异性信号连接到一般 RNAPII 起始前复合转录机制在发起人。MED 的四亚基激酶模块由 CDK8(或 CDK19)、细胞周期蛋白 C、介体复合物亚基 12(Med12)和 Med13 组成,该模块通常与转录抑制有关。MED 磷酸化 cyclin H 以抑制预起始复合物的组装,从而负调节 CTD 上转录因子 II H (TFIIH) 的活性,并磷酸化 CTD-RNAPII 以阻止其与启动子 DNA 的结合并抑制 PIC 的组装。。TFIIH 复合物是 10 亚基通用转录因子的一个组成部分,由调节亚基 cyclin H、催化亚基 CDK7 和无名指蛋白管理 trois 1 (Mat1) 组成,其作为解旋酶 ATP 酶发挥作用和蛋白激酶;它也是最后一个被招募的。DNA 在转录起始位点通过其解旋酶活性解开,在 RNAPII 活性位点形成单链 DNA。TFIIH 复合物中 CDK7 亚基的激酶活性磷酸化 CTD-RNAPII 的 Ser5 和 Ser7,这有助于启动转录和启动子清除。磷酸化的 CTD 还促进随后结合一种加帽酶,该酶催化甲基鸟苷帽添加到新生 mRNA 的 5' 端。作为 CDK 激活激酶 (CAK),CDK7/cyclin H 磷酸化并激活 CDK9,CDK9 作为正转录延伸因子 b (P-TEFb) 的亚基与 T 型细胞周期蛋白(T1 和 T2)结合以释放近端阻滞的启动子并刺激伸长。活化的 CDK9/cyclin T 通过磷酸化负延伸因子 (NELF) 和 5,6-二氯-1-β-D-呋喃核糖基苯并咪唑敏感性诱导因子 (DSIF) 促进前 mRNA 转录物的延伸,以释放停滞的延伸复合物,它在丝氨酸 2 位磷酸化 CTD 以发挥其 RNA 聚合活性。CDK7 对 CTD 的磷酸化是 P-TEFb 募集所必需的,CDK7 的抑制导致 CDK9 对 Ser2 磷酸化的降低。最近的研究表明,CDK12 及其密切的同源物 CDK13 及其相关的辅因子细胞周期蛋白 K 也负责 CTD 处的 Ser2 磷酸化。CDK9 在转录早期磷酸化 Ser2,然后在大部分延伸阶段将其作用传递给 CDK12;然而,CDK12 在 CTD 磷酸化中的作用是基因特异性的。此外,CDK12 还参与细胞对 DNA 损伤的反应所需的选择性外显子剪接,在转录机制和细胞周期调节之间建立了新的联系。CDK1 磷酸化 CTD 以抑制转录,但生理学需要进一步解决。CDK11/cyclin L (cycL) 通过与多种延伸因子相互作用发挥转录延伸作用,如 RNA 聚合酶延伸因子 2 (ELL2)、通用转录因子 II F (TFIIF)、通用转录因子 II S (TFIIS)、并促进染色质转录 (FACT)。此外,CDK11/cyclin L 还通过前 mRNA 剪接的磷酸化因子参与调节 RNA 剪接,例如 SC35 (Srfs2) 和 9G8 (Srfs7。肌浆钙结合蛋白 1 (SCP1) 通过 CTD-RNAPII 的 Ser5 去磷酸化促进转录终止。进一步的研究需要探索去磷酸化的机制;然而,据报道,可能涉及一些抗 CDK 的磷酸酶,例如 Cdc14。
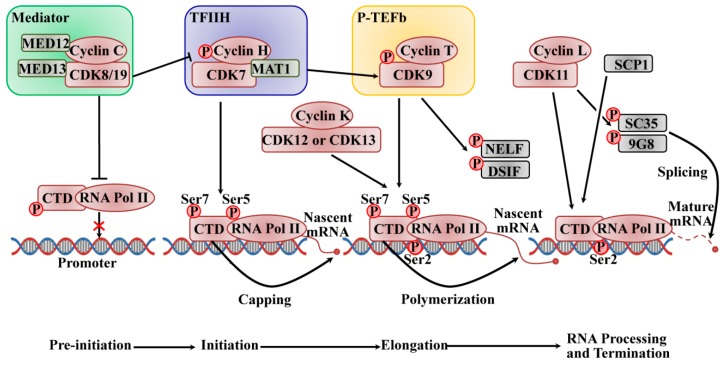
图 2:CDK/cyclin 复合物调节基于 RNAPII 的转录周期的预起始、起始、延伸和终止((2020 Mar 13. doi: 10.3390/ijms21061960)
CDK/cyclin 复合物调节基于 RNAPII 的转录周期的预起始、起始、延伸和终止。CDK8/19 在启动子水平激活转录机制。CDK8/19 还磷酸化 cyclin H 以抑制 PIC 的组装以负调节 TFIIH 的活性,并且它磷酸化 RNAPII 的 CTD 以阻止其与启动子 DNA 的结合并抑制 PIC 的组装。CDK7 和 CDK9 通过 CTD-RNAPII 的连续磷酸化驱动 mRNA 延伸。CDK12 和 CDK13 及其辅因子细胞周期蛋白 K 还负责 CTD 处的 Ser2 磷酸化,从而允许 mRNA 延伸。CDK11 参与转录和 RNA 剪接之间的协调。DSIF 和 NELF 抑制延伸,而 SCP1 促进转录终止。(改编自参考“doi:10.1242/dev.091744”,获得了Development 2013 期刊的许可)。
3.BC 中 CDK 的失调
癌症的标志之一是不受控制的细胞增殖,通过压倒许多保护措施和禁用与 CDK/细胞周期蛋白失调相关的细胞周期检查点。直到最近,大量研究表明导致各种 BC 表型的 CDK/细胞周期蛋白最常见的失调激活改变,这些总结在表格1.
表格1:BCs 中 CDK 的生物学功能总结。
|
CDK |
共同作用蛋白 |
既定职能 |
BC中的生物功能 |
参考 |
|
CDK1 |
细胞周期蛋白 A/B |
与细胞周期的 M 期有关 |
与 MYC 驱动的 三阴性乳腺癌 细胞凋亡有关 |
|
|
CDK2 |
细胞周期蛋白 A/E |
与细胞周期的 G1/S 期相关 |
与 BC 或 三阴性乳腺癌 表型相关 |
|
|
CDK3 |
细胞周期蛋白C |
与 G0/G1 和 G1/S 细胞周期转换相关 |
与 BC 细胞迁移、侵袭、增殖和凋亡有关 |
|
|
CDK4/6 |
细胞周期蛋白D |
与细胞周期的 G1/S 相变有关 |
有助于 BC 启动和维持肿瘤发生 |
|
|
CDK5 |
p35 和 p39 |
推动 G1/S 和 RB 磷酸化的进展;与化疗耐药性和免疫反应有关 |
与 BC 中 ROS 介导的细胞死亡有关;TGF-β1 诱导的上皮间质转化所必需的 |
|
|
CDK7 |
细胞周期蛋白 H |
与 CAK 和 RNAPII 转录相关 |
介导 三阴性乳腺癌 中重要基因簇的转录成瘾 |
|
|
CDK8 |
细胞周期蛋白C |
复杂的 RNAPII 转录;调节转录的起始 |
对 BC 的辅助治疗有反应;与肿瘤进展有关 |
|
|
CDK9 |
细胞周期蛋白T |
RNAPII 转录;促进转录延长 |
新辅助化疗后 BC 患者的预后生物标志物 |
|
|
CDK10 |
细胞周期蛋白M |
调节 ETS2 转录,但不通过 RNAPII 磷酸化 |
与淋巴结转移相关;内分泌治疗耐药 |
|
|
CDK11 |
周期素L |
调节 RNA 转录和剪接、自噬和细胞凋亡 |
与生长和血管生成、增殖和凋亡有关 |
|
|
CDK12 |
细胞周期蛋白 K |
控制可选的最后一个外显子剪接;调节 DNA 损伤、应激和热休克基因的表达 |
促进 BC 细胞侵袭,这是 三阴性乳腺癌 的重要治疗意义;驱动 BC 启动和曲妥珠单抗耐药 |
|
|
CDK13 |
细胞周期蛋白 K |
向新兴 RNA 的中间和 3' 端合成转录本 |
与 DNA 损伤修复、基因组不稳定性相关 |
|
|
CDK14 |
周期素Y |
通过 LRP6 共受体的磷酸化促进 Wnt/β-catenin 信号传导 |
与细胞增殖和侵袭有关 |
|
|
CDK15 |
周期素Y |
参与乙肝病毒驱动的转化 |
与BC细胞侵袭和转移有关 |
|
|
CDK16 |
周期素Y |
调节有丝分裂、细胞凋亡和生长;突触运输和重塑 |
与 TRAIL 相关联 |
|
|
CDK17 |
Cyclin Y |
Promotes amyloid precursor protein-dependent Alzheimer; inhibits autophagy |
Genetic expression profiles and chromosomal alterations |
|
|
CDK18 |
Cyclin Y |
Promotes amyloid precursor protein-dependent Alzheimer; inhibits autophagy; promotes DNA replication stress and stability |
Increases sensitivity to replication stress-inducing chemotherapeutic agents; induces DNA replication stress |
|
|
CDK19 |
Cyclin C |
CDK8 paralog, with a similar role to CDK8, but seems to perform some distinct roles |
BC的化学抗性;为改善化疗提供潜在目标 |
|
|
CDK20 |
细胞周期蛋白 H |
激活 ICK 或 β-catenin-TCF 信号以刺激细胞周期进程 |
CDK20的作用需要在BC进一步解决 |
缩写:MYC—MYC原癌基因,bHLH转录因子;ROS——活性氧;TGF-β1——转化生长因子β1;ETS2——ETS原癌基因2,转录因子;Wnt——无翼/集成;LRP6—LDL受体相关蛋白6;TRAIL——肿瘤坏死因子(TNF)相关的凋亡诱导配体;ICK——肠细胞激酶;TCF——T细胞因子。
参与细胞周期 G1/S 期转变的 CDK4/6-RB 轴在 BCs 中起重要作用。一般来说,cyclin D1/CDK4/6是RB磷酸化促进细胞增殖的关键控制器。预计 CDK4/6-cyclinD/INK4/pRB/E2F 通路或其调节剂的失调有助于肿瘤发生和 BC 维持。实际上,在 BC 临床上观察到 INK4 和 CIP/KIP 家族蛋白的丢失,以及 CDK4/6 的扩增。最近的一项研究表明,不同的 BC 亚型具有不同的细胞周期检查点分子改变。来自 482 名侵袭性 BC 患者的基于数据集的癌症基因组研究表明,27.4% 的 CDK4/6-RB 轴基因失调涉及单基因改变或多基因改变组合的表达。特别是,雌激素可以增加 ER 阳性 (ER+) BC 中细胞周期从 G1 期进展到 S 期的速率,其中细胞周期蛋白 D1-CDK4/6-RB 复合物充当雌激素效应物。简而言之,雌激素与 ER-α 结合驱动细胞周期蛋白 D1 的转录,而 CDK4/6 的刺激和 RB 的磷酸化驱动细胞周期进程通过检查点,导致细胞周期信号的启动以刺激细胞周期蛋白 D1 的表达。多个受体驱动基因参与细胞增殖和存活。大约 15% 的 BC,特别是 ER+ BC中检测到 Cyclin D1 扩增。此外,ER+ BCs 通常表现出雌激素受体 1 (ESR1) 蛋白的上调表达和磷脂酰肌醇-4,5-二磷酸 3-激酶催化亚基 α (PIK3CA) 的高表达,这有助于通过有丝分裂蛋白激酶 B 促进细胞周期进程(AKT)/哺乳动物雷帕霉素靶蛋白 (mTOR) 信号通路。ER+ BC 在基因组上相对稳定,主要依赖于雌激素信号传导,与其他 BC 亚型(如 HER2+ 和 三阴性乳腺癌)相比,它通常具有正常的 RB 和 p53 肿瘤抑制途径功能。同样,HER2 诱导的细胞生长也由 CDK4/6-RB 轴介导。人类 BC 的小鼠模型还表明,细胞周期蛋白 D1-CDK4/6 轴的刺激导致致瘤表型,并有助于 HER2+ BC 中肿瘤发生的启动和维持。随着高度频繁的 HER2+ BC,CDK4 以及 erb-b2 受体酪氨酸激酶 2(ERBB2,编码 HER2 受体的基因)、肿瘤蛋白 p53(TP53)、PIK3CA 以及磷酸酶和张力蛋白同源物(PTEN)的突变被扩增) 和细胞周期蛋白 D1。相反,三阴性乳腺癌 中的基因组、临床和蛋白质组 RB 通路数据显示 20% 的病例 RB1 突变或缺失,9% 的病例显示细胞周期蛋白 E1 扩增,细胞周期蛋白依赖性激酶抑制剂 2A (CDKN2A) 的高水平表达, RB1 的低表达和高增殖率,以及 DNA 损伤反应基因的频繁改变,例如肿瘤抑制性乳腺癌 1 (BRCA1)。cyclin E 的过表达表明 三阴性乳腺癌 预后不良,并与阴性 ER 和 PR 状态相关。。三阴性乳腺癌 还激活 PIK3CA、B-Raf 原癌基因、丝氨酸/苏氨酸激酶 (BRAF)、KRAS 原癌基因、GTP 酶 (KRAS) 和/或 EGFR 和/或 PTEN 缺失的突变或扩增,导致激活异常Raf/MAPK/ERK 或 PI3K/Akt/mTOR 单通路。然而,三阴性乳腺癌 中 PIK3CA 突变率仅为 8.3%。由于 三阴性乳腺癌 中 RB1 的频繁丢失或突变,细胞周期的完整性受到损害,这是由 Rb/E2F/CDK4/6 通路控制的。三阴性乳腺癌 患者通常被认为不适合 CDK 抑制。然而,基于临床前试验,三阴性乳腺癌 对 CDK2/9 抑制剂高度敏感,表明 三阴性乳腺癌 增殖中可能存在涉及 CDK 复合物的未知因素。另一方面,最近的一些研究表明,SAC 的多个基因在 三阴性乳腺癌 中的表达发生了改变,例如 TTK、BUB1、MAD2、极光激酶 B (AURKB) 和 DNA 修复蛋白,可能是由于在 三阴性乳腺癌 中的高度基因组不稳定性。 三阴性乳腺癌。
此外,其他 CDK,如 CDK2,被上调;因此,这通常会导致其伙伴 cyclin A 和 cyclin E 在 BC中的扩增和/或过度表达。CDK1 及其相关的细胞周期蛋白、细胞周期蛋白 A2 和细胞周期蛋白 B1,通常参与有丝分裂进程,并且在 BC 中观察到细胞周期蛋白 B1 的表达增加。然而,没有直接证据证明导致 CDK1 活性失调的基因改变与 BC 发生之间的关系。一项研究表明,由于 CDK12 的缺失导致 DNA 修复缺陷,CDK12 蛋白的缺失显着改善了 三阴性乳腺癌 的表型。转录周期蛋白依赖性激酶 CDK7 介导 三阴性乳腺癌 中重要基因簇的转录添加,而 CDK7 抑制是 三阴性乳腺癌 患者的一种有用疗法。因此,不同的 BC 亚型存在不同的机制。
4.在 BC 治疗中靶向 CDK
鉴于它们在维持癌细胞生长中的作用,细胞周期蛋白和 CDK 是 BC 治疗的有吸引力的目标。在过去十年中,在开发新的有效疗法方面取得了巨大进展,特别是通过将 BC 细胞从增殖表型转移到非分裂状态。CDK4/6抑制剂主要通过阻断RB磷酸化来抑制细胞周期,被广泛研究,并获得了最具吸引力的发现。根据对 CDK 的特异性,CDK 抑制剂被分类为相对非选择性的泛抑制剂或对单个 CDK 具有选择性。到目前为止,CDK 抑制剂药物进入了 BC 省的众多临床试验,而不是不可逆的 ATP 竞争性(共价)抑制、可逆和不可逆的变构抑制以及抗体-药物偶联 (ADCs)。
4.1 BC 省的早期泛 CDK 抑制剂
大多数早期的CDK抑制剂表现出相对非特异性的抑制作用,它们被称为泛CDK抑制剂。许多泛 CDK 抑制剂在 II 期试验之前失败,因为它们作为单一疗法的临床活性有限,由脱靶细胞的不良靶抑制引起的剂量限制性毒性,如恶心、呕吐、疲劳、肝功能障碍、神经病变、骨髓抑制、和胃肠道影响,以及缺乏这些药物对患者的预测性生物标志物。早期的泛CDK抑制剂包括flavopiridol(也称为alvocidib,由Sanofi-Aventis开发)、dinaciclib(也称为SCH 727965,由Merck开发)和seliciclib(也称为roscovitine,由Cyclacel开发),以及有丝分裂激酶抑制剂,例如 AURKB 和 PLK1。最初表明 CDK1、CDK2 和 CDK5 是 seliciclib 的目标;然而,随后的数据表明,它还通过 CDK7 和 CDK9 抑制转录。
在这些第一代抑制剂中,flavopiridol 是一种从 rohitukine(一种色酮生物碱)中提取的半合成类黄酮,在 1998 年至 2014 年间进行了 60 多项临床试验。它通过抑制 CDK1、CDK2、CDK4、 CDK6、CDK7 和 CDK9 。Flavopiridol 导致 G1 和 G2 期的细胞周期停滞;然而,后来的研究表明,在某些情况下,它还通过阻断 CDK7 和 CDK9 以及 c-MYC 的转录活性来诱导细胞毒性反应。在实体恶性肿瘤(如肾脏、前列腺和晚期肉瘤)的几项 I 期试验中,黄酮哌啶醇作为单药有效,因为它与其他化学疗法联合导致 BC 疗效不足,而在实体瘤的 II 期研究中报告了低水平的临床活性。然而,有证据表明,flavopiridol 可能在血液恶性肿瘤中具有临床活性,例如慢性淋巴细胞白血病 (CLL) 和套细胞淋巴瘤。Seliciclib 是 CDK1、CDK2、CDK5 和 CDK7 的抑制剂,在临床前和临床研究中作为单一疗法没有显示出显着的抗肿瘤活性。在联合化疗治疗实体瘤的临床研究中,副作用常见,如恶心、高血糖和低钾血症。此外,最重要的泛 CDK 抑制剂之一 dinaciclib 可抑制 CDK1、CDK2、CDK5 和 CDK9,对 RB 磷酸化具有卓越的抑制效力,与黄酮吡醇相比,其治疗指数有所提高。在一些实体瘤的异种移植模型中,如卵巢癌和胰腺癌、小儿急性淋巴细胞白血病 (ALL) 和神经母细胞瘤-RAS 病毒癌基因同源物 (NRAS)-突变黑色素瘤,它在阻断肿瘤细胞增殖方面表现出很高的活性。不幸的是,卑诗省的初步结果令人失望。dinaciclib 与卡培他滨治疗晚期乳腺癌 (ABC) 的 II 期随机临床试验由于其疗效不如卡培他滨而被终止。此外,临床前研究表明,dinaciclib 与蒽环类药物的组合在 BC 细胞系中具有协同作用,而 dinaciclib 与表柔比星联合在转移性 BC (MBC) 患者中的 I 期研究显示无反应和高毒性。最后,dinaciclib 治疗可能对 MYC 过表达的 三阴性乳腺癌 有效,因为它可以抑制肿瘤的生长并提高临床前小鼠模型的存活率。与黄酮吡醇同时,临床评估了一种基于嘌呤的 CDK 抑制剂罗可维汀。不幸的是,目前只有一项针对库欣病的 roscovitine 的试验正在进行中。一般来说,第一代泛CDK抑制剂显示出低治疗指数和高毒性。正在进行的研究旨在利用新的 CDK 抑制剂来规避这些限制。
4.2. CDK4/6 选择性抑制剂在 BC 中的临床成功
ER+ BC 患者内分泌治疗引起的耐药性为开发 CDK 抑制剂提供了机会。CDK4/6 抑制剂在 ER+ BC 的临床前和临床试验中均获得了有效批准,尤其是与抗雌激素疗法联合使用时。选择性 CDK4/6 抑制剂 帕博西尼 (PD0332991)、瑞博西尼 (LEE011) 和 玻玛西尼 (LY2835219) 已获美国食品药品监督管理局 (FDA) 和欧洲药品管理局 (EMA) 批准用于治疗 ER+/HER2−晚期和转移性 BC (A/MBC),在 ER+ BC 中表现出剂量依赖性生长抑制。这三种药物都是小分子的 ATP 竞争性药物,可与 CDK4 和 CDK6 的 ATP 结合口袋结合,并与 ATP 结合裂隙中的残基发生特异性相互作用。然而,玻玛西尼 似乎很容易通过将两个氟原子埋在 ATP 结合口袋的后壁上而与 ATP 裂隙结合,并且它的结合选择性低于 瑞博西尼 和 帕博西尼。帕博西尼 对 36 种其他激酶没有活性,而 瑞博西尼 对 ER+/HER2-ABC 联合抗雌激素疗法(例如来曲唑)的治疗对 CDK1/2 没有作用。帕博西尼 和 玻玛西尼 对 CDK1、CDK2、CDK7 和 CDK9 的效力降低,它们已注册用于氟维司群的二线治疗。报告的评估 BC 中 CDK4/6 抑制剂的临床试验显示在表 2.
表 2: 报告的临床试验评估了 BC 中的 CDK4/6 抑制剂
|
试验名称 |
阶段 |
治疗臂 |
人口 |
病人数量 |
PFS |
最常见的 AE |
|
PALOMA-1/TRIO-18 |
II |
1. 帕博西尼 + 来曲唑 |
绝经后女性,ER+/HER2−ABC 的一线治疗 |
177 |
1. 20.2 个月 |
中性粒细胞减少症、白细胞减少症、疲劳 |
|
PALOMA -2 ( NCT01740427 ) |
III |
1. 帕博西尼 + 来曲唑 |
ER+/HER2− ABC |
666 |
1. 19.3 个月 |
中性粒细胞减少症、白细胞减少症、恶心、疲劳、关节痛、脱发 |
|
PALOMA -3 |
III |
1. 帕博西尼 + 氟维司群 |
HR+/HER2− ABC |
521 |
1. 9.2 个月 |
中性粒细胞减少症、白细胞减少症、血小板减少症、疲劳、恶心、头痛、脱发 |
|
帕拉斯( NCT02513394 ) |
III |
1. 帕博西尼 2 年 + 标准辅助 ET 5 年 |
ER+/HER2− 早期 BC |
5795 |
没有详细数据 |
没有详细数据 |
|
佩内洛普-B ( NCT01864746 ) |
III |
1. 帕博西尼,125 mg,每天一次,28 天周期,共 13 个周期 |
HR +/HER2- 正常原发性 BC 新辅助化疗后复发风险高 |
1250 |
没有详细数据 |
没有详细数据 |
|
MONALEESA-1 ( NCT01919229 ) |
II |
1.来曲唑+瑞博西尼。 |
具有 HR+/HER2− 早期 BC 的绝经后妇女 |
14 |
Ki67 表达细胞的平均减少,1. 92%, 2. 69% |
恶心、食欲下降、腹泻、腹痛、疲劳、虚弱 |
|
MONALEESA-2 |
III |
1. 瑞博西尼 + letrozole |
Postmenopausal women with HR+/HER2− MBC received no prior therapy for advanced disease |
668 |
1. 19.3 months |
Neutropenia, leukopenia, nausea, fatigue, diarrhea, alopecia |
|
MONALEESA-3 (NCT02422615) |
III |
1. 瑞博西尼 + fulvestrant |
Postmenopausal women with HR+/HER2− ABC received no or only one line prior endocrine treatment |
726 |
1. 20.5 months |
Neutropenia, leukopenia, nausea, fatigue, diarrhea, alopecia, vomiting, constipation, arthralgia, cough, headache, rash, anemia |
|
MONALEESA-7 (NCT02278120) |
III |
1. 瑞博西尼 + NSAI/tamoxifen + goserelin |
Premenopausal or perimenopausal women with ER+/HER2−ABC |
672 |
1. 23.8 months |
Neutropenia, leukopenia, increased ALT, increased AST, anemia, hypertension |
|
MONARCH-1 (NCT02102490) |
II |
玻玛西尼 |
heavily treated HR+/HER2− M/ABC patients (brain metastases were excluded) |
132 |
6.0 months (95% confidence interval (CI) 4.2 to 7.5) |
Leucopenia, neutropenia, diarrhea, fatigue, nausea, hypokalemia, increased ALT, decreased appetite, hyponatremia, abdominal pain, thrombocytopenia |
|
MONARCH-2 (NCT02107703) |
III |
1. 玻玛西尼 + fulvestrant |
HR+/HER2− locally advanced or metastatic BC. |
669 |
1. 16.4 months |
Neutropenia, diarrhea, nausea, fatigue, abdominal pain |
|
MONARCH-3 ( NCT02246621 ) |
III |
1. 玻玛西尼 + 阿那曲唑/来曲唑 |
绝经后妇女 HR+/HER2− 局部、复发或 MBC |
493 |
1. 28.2 个月 |
中性粒细胞减少症、腹泻、恶心、疲劳、感染 |
缩写:ER——雌激素受体;HER2——人表皮生长因子 2;ABC——晚期乳腺癌;MBC——转移性乳腺癌;编号——编号;ET——内分泌治疗;PFS——无进展生存期;AEs——不良事件;NSAI——非甾体芳香酶抑制剂;ALT——丙氨酸氨基转移酶;AST——天冬氨酸氨基转移酶。
帕博西尼 (IBRANCE; PD0332991; Pfizer; C 24 H 29 N 7 O 2 ) 是第一个获准用于 BC 治疗的 CDK4/6 抑制剂。它是一种可逆的、口服的、强效的 CDK4/6 小分子选择性抑制剂,酶促半数最大抑制浓度 (IC 50 ) 对 CDK4 为 11 nM,对 CDK6 为 15 nM。事实上,人类 BC 细胞系根据其表型对 帕博西尼 表现出不同的敏感性。具有管腔特征的 ER+ BC 细胞系对 帕博西尼 比具有基底样和 三阴性乳腺癌 组织学的 ER-BC 细胞更敏感。帕博西尼 预计依赖于功能性 RB 蛋白的存在,该蛋白通过 cyclin D-CDK4/6 阻止 RB 在 Ser 780 处的磷酸化,从而导致细胞周期停滞在 G1 期。与 RB 代表 CDK4/6 在细胞周期中的主要限速靶点的概念和 帕博西尼 的激酶选择性谱一致,它在 RB 缺陷细胞中没有显示出抗增殖活性,其中对 CDK4/6 的要求是绕过。早期试验显示 帕博西尼 在 ER+/HER2-ABC 中的疗效。MBC患者的I期帕博西尼试验表明,初步的安全反应和可耐受的毒性有利于进入下一阶段的研究,骨髓抑制是主要的剂量限制毒性(DLT)。开放标签随机 II 期临床试验 PALOMA-1(也称为 TRIO-18)研究了 帕博西尼(125 mg,3/1 方案)加来曲唑(一种参与雌激素生物合成关键步骤的酶)的安全性和有效性或单独来曲唑用于先前未经治疗的 ER+/HER2- ABC 的绝经后妇女。结果显示,与单用来曲唑相比,来曲唑联合帕博西尼组的中位无进展生存期(PFS)显着增加(从 10.2 个月至 20.2 个月),中位总生存期(OS)也得到改善。联合治疗。根据 PALOMA-1 试验的结果,FDA 于 2015 年 2 月 3 日提供加速(临时)批准 帕博西尼(Ibrance)联合来曲唑用于治疗 ER+/HER2- ABC 绝经后妇女。在取得有希望的结果之后,进行了随机、双盲、III 期 PALOMA-2 ( NCT01942135 ) 临床试验,以确认 帕博西尼 联合来曲唑的显着临床益处和安全性,联合治疗的中位 PFS 为 24.8 个月,而联合治疗为 14.5 个月单独来曲唑组几个月。总体生存数据显示向 帕博西尼 组的趋势不显着。同样,主要的不良事件 (AE) 是中性粒细胞减少症。根据 PALOMA-2 的数据,FDA 于 2017 年定期批准 帕博西尼 联合芳香酶抑制剂用于治疗 ER+/HER2− ABC/MBC。最后,随机、双盲、安慰剂对照的 III 期试验 PALOMA-3 试验通过比较 帕博西尼 和氟维司群与安慰剂和氟维司群对 ER+/HER2- 患者的治疗,测试了 帕博西尼 与氟维司群(ER 下调剂和拮抗剂)的疗效。绝经前和绝经后内分泌治疗期间复发或进展的 MBC。与单独使用氟维司群相比,帕博西尼 联合氟维司群改善了中位 PFS,从 4.6 个月提高到 9.5 个月。基于这些结果,FDA 于 2016 年 2 月 19 日批准将 帕博西尼 (Ibrance) 与氟维司群联合用于治疗 ER+/HER2− ABC/MBC 女性。此外,许多正在进行的研究正在探索 帕博西尼 在 ER+/HER2- 早期 BC 患者中的应用,包括辅助和新辅助研究,例如 PALLAS ( NCT02513394 ) 和 PENELOPE-B ( NCT01864746 ) 的随机 III 期研究;初步结果预计在 2020 年。此外,帕博西尼 与其他靶向药物(如他莫昔芬和曲妥珠单抗)的组合显示出协同相互作用并有效抑制 ER+ BC 细胞系的增殖。
瑞博西尼 (KISQALI; LEE011; Novartis; C 23 H 30 N 8 O) 是另一种口服药物,对 CDK4/6 具有高效的生物利用度选择性抑制作用,对 CDK1 和 CDK2 缺乏显着活性,酶促 IC 50为 10 nM对于 CDK4 和 40 nM 对于 CDK6。与 帕博西尼 类似,它通过抑制 RB 磷酸化来阻断 RB 阳性 (RB+) BC 细胞系,并导致肿瘤细胞的细胞周期停滞。在一项 I 期 瑞博西尼 单药剂量递增研究中报告了药代动力学数据(NCT01237236),表明单药治疗中 瑞博西尼 的剂量为 50 至 1200 mg(3/1 时间表),以及 600 mg(每天一次,连续)连续三周和一周停药,最大耐受剂量为 900 mg 来自 RB+ 晚期实体瘤(包括 18 名乳腺癌患者)或淋巴瘤,而最常见的 DLT 是中性粒细胞减少症和血小板减少症。在 II 期试验 MONALEESA-1 ( NCT01919229 ) 中,患有 ER+/HER2- 早期 BC 的绝经后妇女在手术前两周接受来曲唑联合或不联合 瑞博西尼(400 或 600 mg)治疗。研究表明,瑞博西尼 加来曲唑组合耐受性良好,治疗后未观察到 3/4 级 AE。一项随机双盲、安慰剂对照、III 期 MONALEESA-2 ( NCT01958021 ) 试验招募了 668 名绝经后 HR+/HER2- ABC 患者,这些患者既往未接受过晚期疾病治疗;他们接受了 瑞博西尼(600 毫克/天,三周/休息一周)加来曲唑(2.5 毫克/天)或安慰剂加来曲唑,直到终点。试验表明,与单用来曲唑相比,瑞博西尼 和来曲唑的联合治疗显着延长 PFS(从 16 个月至 25.3 个月),这导致 FDA 批准 瑞博西尼(Kisquali)联合来曲唑抑制剂作为一线治疗HR+/HER2− M/ABC,2017 年 3 月 13 日。随机双盲,MONALEESA-3 ( NCT02422615) III 期试验旨在用于 HR+/HER2− ABC 患者的绝经后妇女,这些患者之前未接受或仅接受过一种内分泌治疗,以评估 瑞博西尼 或安慰剂与氟维司群的疗效。试验表明,与安慰剂和氟维司群相比,在氟维司群中添加 瑞博西尼 的中位 PFS 显着改善(20.5 个月对 12.8 个月)。基于这一结果,FDA 于 2018 年 7 月批准了这种治疗组合用于 HR+/HER2-M/ABC 患者的一线或二线治疗。最近,另一个随机双盲,MONALEESA-7 ( NCT02278120) III 期试验专门针对接受卵巢功能抑制和口服内分泌治疗(他莫昔芬和戈舍瑞林或非甾体芳香化酶抑制剂 (NSAI) 和戈舍瑞林)联合或不联合利博西尼的绝经前 HR+/HER2− ABC 患者。研究表明,瑞博西尼 与内分泌治疗的组合显着提高了 23.8 个月的中位 PFS,而安慰剂组 NSAI/他莫昔芬加戈舍瑞林组的中位 PFS 为 13.0 个月。此外,还有大量其他正在进行的试验探索 瑞博西尼 与其他针对 BC 的靶向药物联合使用,例如 PACE 试验 ( NCT03147287 ) 和 MAINTAIN 试验 ( NCT02632045 )),正在进行评估 瑞博西尼 在先前用 CDK4/6 抑制剂治疗的 HR + MBC 患者中的疗效。此外,TRINITI-1 试验 ( NCT01857193 ) 正在评估依维莫司与 瑞博西尼 的三重组合以及先前使用 CDK4/6 抑制剂的依西美坦进展患者的效果。NCT03238196的研究正在评估厄达非替尼与 瑞博西尼 和氟维司群的三重组合在 HR + MBC 中的作用。
玻玛西尼 (VERZENIO; LY2834219; Lilly; C 27 H 32 F 2 N 8 ) 是一种口服有效的 CDK4/6 抑制剂,酶促 IC 50低,即 CDK4 为 2 nM,CDK6 为 10 nM,与剂量相关RB磷酸化的依赖性抑制和G1期细胞周期停滞,导致增殖抑制和细胞数量减少。玻玛西尼 不仅抑制 CDK4/6,还抑制其他一些更复杂的药理功能,包括有效的 CDK9 和 Pim-1 原癌基因、丝氨酸/苏氨酸激酶 (PIM1),尽管效力较低。一项临床前研究表明,玻玛西尼 可以单独使用或与其他药物联合使用。与 帕博西尼 相比,玻玛西尼 可以在较低剂量下穿过血脑屏障,并且可能在靶标上停留的时间更长。因此,这些特性正在研究用于脑转移患者的抗肿瘤治疗。玻玛西尼 单药治疗的 I 期试验(单药治疗 200 mg 或与内分泌治疗一起给予 150 mg)显示,在经过大量预处理的 HR + BC 患者中,总体反应率为 31% 和 61%,达到反应或病情稳定持续超过 6 个月,表明 玻玛西尼 作为单一疗法可能有益。单臂 II 期研究 MONARCH-1 ( NCT02102490) 用于评估单独使用 玻玛西尼 对重度治疗的 HR+/HER2-M/ABC 患者(排除脑转移)的安全性和有效性,每 12 小时连续给药 200 mg 玻玛西尼,直至疾病进展。该研究证实客观缓解率 (ORR) 为 19.7%,而临床受益率为 42.4%,中位 PFS 为 6.0 个月。根据结果,FDA 于 2017 年 9 月批准了预后不良的 BC 患者组。此外,随机、双盲、安慰剂对照的 MONARCH 2 ( NCT02107703) 对既往接受过新辅助或辅助内分泌治疗并在内分泌治疗后复发的 HR+/HER2− ABC 患者进行 III 期临床试验。患者按 2:1 随机分组,接受 玻玛西尼 或安慰剂与氟维司群。研究表明,与单独使用氟维司群相比,玻玛西尼 与氟维司群的组合显着改善了中位 PFS(16.4 个月对 9.3 个月),这导致 FDA 批准 玻玛西尼 (Verzenio) 与氟维司群联合用于 HR+/HER2- 患者M/ABC 于 2017 年 9 月作为二线治疗。另一个 III 期 MONARCH 3 ( NCT02246621) 研究治疗被提议作为未接受先前治疗的 HR+/HER2- MBC 患者的一线治疗。与安慰剂加阿那曲唑或来曲唑相比,患者按 2:1 随机分配接受 玻玛西尼 联合阿那曲唑或来曲唑。结果显示,玻玛西尼 组的中位 PFS 优于安慰剂组(28.18 个月对 14.76 个月),这也导致 FDA 批准 玻玛西尼 (Verzenio) 与芳香酶疗法联合用于 HR+/HER2-M/ABC 患者2018 年 2 月作为一线治疗。此外,在 BC 进行的其他正在进行的 玻玛西尼 研究,如 neoMONARCH ( NCT02441946) II 期临床试验,比较 玻玛西尼 联合阿那曲唑与 玻玛西尼 单药治疗和阿那曲唑单药治疗两周的生物学效应,并在随后的 14 周内评估 玻玛西尼 联合阿那曲唑 HR+/HER2− 的活性和安全性美国广播公司。monarchE 研究 ( NCT03155997 ) 评估了 玻玛西尼 联合标准内分泌治疗与单独内分泌治疗在高风险、淋巴结阳性、早期 BC 中的安全性和有效性。
除了 FDA 批准的三种化合物外,其他几种 CDK4/6 抑制剂正在探索中,正在进行的临床研究评估它们单独或与其他靶向疗法联合作为 BC 标准化疗的效果。例如,正在开展国际、开放标签、随机临床试验、III 期研究 PEARL ( NCT02028507 ),以测试 帕博西尼 与内分泌治疗与化疗(卡培他滨)在绝经后 HR+/HER2-MBC 中对芳香酶抑制剂的耐药性。国际多中心随机临床试验 Ib/II 期研究 PASTOR ( NCT02599714) 正在评估 vistusertib 加 帕博西尼 加氟维司群与安慰剂加 帕博西尼 加氟维司群对 ER+ 局部 A/MBC 绝经后患者先前接受激素治疗。除了 HR+/HER2-A/MBC,正在进行和招募的临床试验正在评估 CDK4/6 抑制剂在其他 BC 亚型中的活性,例如 HER2+ BC 和 三阴性乳腺癌。帕博西尼/瑞博西尼联合比卡鲁胺治疗AR+ 三阴性乳腺癌(NCT02605486 / NCT03090165)。monarcHER ( NCT02675231 ) 研究还对 玻玛西尼 进行了积极的临床研究,用于治疗至少两次 HER2 定向治疗后的 HR+/HER2+ M/ABC。一些正在进行的针对 HR+/HER2+ M/ABC 或 三阴性乳腺癌 患者评估 CDK4/6 抑制剂的临床试验列于表3.
表3:正在进行的临床试验评估 CDK4/6 抑制剂用于 HR+/HER2+ M/ABC 或 三阴性乳腺癌患者。
|
试验名称 |
阶段 |
地位 |
设计 |
治疗臂 |
人口 |
入读分数 |
目标 |
|
NCT02947685 |
III |
R |
随机、平行分配、开放标签 |
1. 帕博西尼 + 抗 HER2 治疗(曲妥珠单抗/帕妥珠单抗)+ ET(来曲唑、阿那曲唑、依西美坦、氟维司群) |
HER2+/ER+ BC |
496(估计) |
PFS、OS、ORR、DOR、CBR、安全性、3 年和 5 年生存概率 |
|
NCT02774681 |
II |
终止 |
单组分配,打开标签 |
1. 帕博西尼 PO |
HER2+/PR- MBC 伴脑转移 |
12(估计) |
AE、CNS、PFS、OS、CNS、ORR、安全性、耐受性 |
|
NCT02530424 |
II |
主动,N/R |
单组分配,打开标签 |
(曲妥珠单抗 + 帕妥珠单抗 + 帕博西尼 ± 氟维司群)+ 手术 |
ER+/HER2+ BC 适合新辅助治疗 |
102(实际) |
PCR、COR、安全性、耐受性 |
|
NCT02657343 |
Ⅰb/Ⅱ |
主动,N/R |
非 |
1. 瑞博西尼 + T-DM1 |
HER+ A/MBC |
26(实际) |
Mtd、RP2D、CBR、ORR、PFS、操作系统。 |
|
NCT03913234 |
I/II |
还没有R |
单组分配,打开标签 |
瑞博西尼 + 曲妥珠单抗 + 来曲唑 |
绝经后 HER2+ MBC |
95(估计) |
PFS、OS、RT、QOL |
|
NCT03054363 |
Ⅰb/Ⅱ |
R |
非 |
图卡替尼 + 帕博西尼 + 来曲唑 |
HR+/HER2+ A/MBC |
25(估计) |
不良事件,PFS |
|
NCT03993964 |
II |
还没有R |
单组分配,打开标签 |
吡罗替尼 + SHR6390 |
HER2+ ABC |
20(估计) |
ORR、PFS、操作系统 |
|
NCT03090165 |
I/II |
Active,N/R |
Single group assignment, open label |
1. bicalutamide + 瑞博西尼 400mg PO daily on days 1-21 of a 28-day cycle. |
AR+ 三阴性乳腺癌 |
11 (actual) |
ORR, DOR, safety, tolerability, PFS, OS, CBR, |
|
NCT03805399 |
Ib/II |
R |
Non- |
1. Pyrotinib + Capecitabine |
三阴性乳腺癌 |
140 (estimated) |
ORR, DOR, PFS, OS |
|
NCT03519178 |
II |
R |
Non- |
1. PF-06873600 |
HR+/HER2− MBC, 三阴性乳腺癌 |
220 (estimated) |
DL, safety, tolerability, ORR, Cmax, Tmax, PK |
|
NCT02907918 |
II |
R |
Single group assignment, open label |
(帕博西尼 + letrozole + trastuzumab +/- goserelin) + surgery |
ER+/HER2+ Stage II-III BC |
48 (estimated) |
PCR, safety, tolerability |
|
NCT02605486 |
I/II |
R |
Single group assignment, non- |
帕博西尼 + Bicalutamide |
AR+/ER− MBC |
51 (estimated) |
RP2D, PFS, ORR, CBR, safety, tolerability |
|
NCT02675231 |
II |
Active, N/R |
Randomized, parallel assignment, open label |
1. 玻玛西尼 + Trastuzumab + Fulvestrant |
HR+/HER2+ A/MBC |
225(估计) |
PFS、操作系统、CR、PR、DOR |
缩写:Pts——患者;ABC——晚期乳腺癌;MBC——转移性乳腺癌;三阴性乳腺癌——三阴性乳腺癌;R——招募;N/R——不招募;ET——内分泌治疗;PO——佩罗斯;T-DM1-曲妥珠单抗 emtansine/Kadcyla;PD-1——程序性细胞死亡蛋白 1;PARP——聚(ADP-核糖)聚合酶;BLIS——基础样免疫抑制;VEGFR——血管内皮生长因子受体;MES——间充质;mTOR——雷帕霉素的哺乳动物靶点;AR——雄激素受体;PFS——无进展生存期;OS——总生存期;ORR——总体反应率;DOR——反应持续时间;CBR——临床受益率;CNS——中枢神经系统;PCR——病理完全反应;Mtd——最大耐受剂量;RP2D——推荐的第 2 阶段剂量;AEs——不良事件;Cmax——最大浓度;Tmax——达到最大血浆浓度的时间;PK——药代动力学;CR——完全响应;PR——部分回应;COR——临床客观反应;RT——响应率;QOL——生活质量;DL——剂量限制。
4.3. BC中的新型CDK抑制剂
随着对不同 BC 亚型 CDKs 的深入了解,以及 CDK4/6 抑制剂在 HR+/HER2-A/MBC 中的应用成果,以及对目前广泛使用的抑制剂的副作用和耐药性的出现,目前的探索针对细胞周期靶点的新 CDK 抑制剂的研究引起了更多的兴趣。
目前,发现了许多新的CDK抑制剂。郑等人。发现 piperlongumine (PL) 抑制 ER+ BC 细胞增殖和迁移。PL 作为从辣椒中提取的天然产物,可抑制 CDK1 和 CDK4/6 的表达水平,并诱导 G2/M 期细胞周期停滞以抑制肿瘤发生。克雷达等人。发现SR-4835是CDK12和CDK13的高选择性双重抑制剂,可抑制三阴性乳腺癌细胞增殖。Panduratin A (PA) 具有多种作用,具有抗炎、抗菌、抗氧化和抗癌活性。PA 还通过剂量依赖性地降低 CDK4 和细胞周期蛋白 D1 的表达来阻断 G0/G1 期的细胞周期。Vanicoside B 是黄酮苷的苯丙酰蔗糖衍生物,在 12 - O -tetradecanoylphorbol-13-acetate (TPA) 诱导的皮肤癌发生小鼠模型中既可用作 PKC 抑制剂,也可用作化学预防剂。金等人。发现 Vanicoside B 抑制 CDK8 介导的信号通路和上皮转化蛋白的表达,并在 MDA-MB-231 和 HCC38 细胞中诱导细胞周期停滞。蛋白磷酸酶 Mg 2+/ Mn 2+依赖性 1A (PPM1A) 是 Ser/Thr 蛋白磷酸酶 2C 家族的成员,通过减少 三阴性乳腺癌 中的 CDK 和 RB 磷酸化参与调节增殖、细胞侵袭和迁移。于等人。发现抑制 COP9 信号体复合物亚基 4 (CSN4) 的亚基会增加亚 G1 细胞群并通过调节 BC 细胞系 MDA-MB-231 中的 CDK6 诱导细胞凋亡。β-Thujaplicin 是一种天然单萜类化合物,可诱导 G0/G1 期细胞周期停滞,并调节细胞周期介质 cyclin D1、cyclin E 和 CDK4,从而抑制 ER-basal-like MCF10DCIS.com 的增殖。人类 BC 细胞。成风虫乙醇提取物 (FFE) 通过抑制细胞周期调节蛋白(如 CDK2、细胞周期蛋白 A/E 和 S 期激酶相关蛋白 2 (Skp2))的表达来阻止 S 和 G2/M 细胞群,从而导致细胞凋亡通过靶向 AKT 和减少 MDA-MB-231 细胞的迁移。最近,研究人员发现一种新型水溶性双(羟甲基)链烷酸酯类姜黄素衍生物 MTH-3 通过下调 CDK1 的表达参与 MDA-MB-231 细胞的 G2/M 期阻滞。同样,(5, 7, 8-trihydroxyflavone (NOR-wogonin) 是一种具有抗肿瘤活性的多羟基黄酮。它与非致瘤性 BC 系(MCF-10A 和 AG11132)通过下调 CDK1 的表达。此外,高良姜素是另一种植物抗癌化合物,通过下调 CDK1、CDK2 和 CDK4 抑制 MCF-7 细胞的存活并诱导细胞凋亡, 导致细胞周期停滞。5,7-二羟基-2-[4'-羟基-3'-(甲氧基甲基)苯基]-6-C-β-吡喃葡萄糖基黄酮(来自莳萝球茎)诱导G0/G1 期阻滞和细胞凋亡,以及通过靶向 CDK1 和 CDK6 抑制 BC 细胞中的血管生成。白藜芦醇通过靶向 miR-122-5 提高 BC 化疗的敏感性并阻止癌症的发展,然后影响 CDK2、CDK4 和 CDK6 的表达,导致细胞周期停滞。淫羊藿苷是从淫羊藿中提取的具有抗肿瘤活性的主要成分,在他莫昔芬耐药的 BC 细胞系 MCF-7/TAM 中降低 CDK2 和 CDK4 的表达,导致细胞周期停滞。酪氨酸激酶 WEE1 抑制剂 AZD 1775 具有很强的抗增殖作用。金等人。发现 AZD 6738 和 AZD 1775 的联合使用会激活 CDK1,导致 DNA 损伤、有丝分裂缺陷和细胞死亡。一种微管靶向剂甲基2-(-5-氟-2-羟基苯基)-1 H-benzo [d] imidazole-5-carboxylate (MBIC) 调节 p53 的表达,然后下调 CDK1 的表达,导致细胞死亡。
此外,microRNAs (miRNAs) 是内源性单链非编码 RNA,大小为 20-24 nt,与靶 mRNA 的 3'-非翻译区 (3'-UTR) 特异性结合,诱导靶标降解。 mRNA 或抑制其蛋白质翻译过程。研究发现,BC中多个异常表达的miRNA直接靶向CDK并参与肿瘤进展的调控。在大多数人类 BC 标本和细胞系中,miR-424 的表达降低,而 miR-424 的表达增加会降低 CDK1 的表达,从而导致 G2/M 细胞周期停滞并抑制细胞增殖。MiR-128-3p 通过影响 CDK4/6/cyclin D1 和 CDK2/cyclin E1 的表达来抑制 BC 细胞的增殖和运动,导致 G0/G1 期阻滞。MiR-122-5 还直接靶向 CDK2、CDK4 和 CDK6,导致细胞周期停滞。MiR-141-3p 在曲妥珠单抗耐药细胞系中下调,miR-141-3p/CDK8 的失调表达降低了耐药性并抑制细胞迁移和侵袭。刘等人。发现 hsa_circ_0136666 的上调通过海绵化 miR-1299 和靶向 CDK6 抑制 BC 的增殖、迁移和侵袭来促进 BC 的进展。此外,郑等人。发现长链非编码 RNA CASC2/miR-18a-5p/CDK19 参与 BC 化学抗性,非编码 RNA 00511 (LINC00511)/miR-29c/CDK6 参与 BC 细胞中的紫杉醇细胞毒性。综上所述,这些 miRNA 可用作新型 CDK 抑制剂的候选靶标,用于 miRNA 拮抗剂(也称为 antagomir 或 antimiRs,基因沉默疗法)或 miRNA 模拟物(也称为 miRNA 替代疗法,替代疗法)的 BC 治疗目的。
4.4. CDK抑制剂与其他药物的联合治疗
BC是一种具有挑战性的实体癌类型,单一疗法CDK抑制剂治疗可能导致许多缺陷;因此,CDK抑制剂联合其他临床药物可能会获得协同治疗和良好的疗效。最近,帕博西尼/紫杉醇的序贯治疗比单一治疗更有效地抑制细胞增殖和增加细胞死亡。Paclitaxel 抑制 帕博西尼 介导的 AKT 诱导并下调 RB/E2F/c-myc 信号通路。帕博西尼/紫杉醇序贯联合用药可增强对糖代谢的抑制作用,帕博西尼 预处理可显着提高化疗的疗效。然而,同时使用 帕博西尼 和紫杉醇会产生拮抗作用。凯特纳等人。发现使用 STAT3 和聚 (ADP-核糖) 聚合酶 (PARP) 抑制剂组合靶向白细胞介素 6 (IL6)/信号转导和转录激活因子 3 (STAT3) 和 DNA 修复缺陷可以有效治疗 帕博西尼 耐药的 ER+ BC. 梅塞尔等人。报道了 帕博西尼 与放疗联合使用以增强放疗效果,通过 G1 细胞周期停滞提高存活率和减少细胞增殖的病例。在 MDA-MB-231 细胞中,PTC-209 和 帕博西尼 表现出更显着的剂量依赖性细胞毒性作用,导致抑制胰岛素信号传导、粘着斑、DNA 损伤反应和 Wnt/多能性信号传导,从而减少集落和球体形成,细胞迁移和细胞活力。此外,PI3K/AKT/mTOR信号通路是ER+BC中的重要通路。因此,将 CDK4/6 抑制剂与芳香化酶或 瑞博西尼 和 PI3K 抑制剂 alpelisib (BYL719) 相结合,与单药治疗相比,可促进肿瘤消退并改善 PFS。然而,最近的数据显示,PI3K 抑制剂的应用似乎并不令人满意,因为它的作用适中且毒性大,而依维莫司(一种 mTOR 抑制剂)与毒性较小的内分泌治疗 (ET) 联合使用时可明显提高 PFS。另一方面,最近的数据表明,CDK-RB-E2F 通路在 CDK4/6 抑制剂耐药的 BC 细胞系中被重新激活,但它对雷帕霉素复合物 1/2 (mTORC1/2) 抑制剂的哺乳动物靶标敏感。因此,mTORC1/2 抑制剂和 CDK4/6 抑制剂的联合使用在 E2F 依赖性转录和细胞增殖抑制方面将更有效地克服对 CDK4/6 抑制剂的耐药性。
5. 靶向药物基因解码基因检测评论
非常清楚的是,CDK 复合物在细胞增殖、基因转录和细胞周期进程控制中具有核心作用,形成了一个系统来调节细胞周期促进活性,以响应各种细胞内情景和细胞外信号。对细胞周期失调在 BC 中的作用的持续研究导致确定它们作为癌症治疗的有吸引力的靶标的潜力。许多新型 CDK 抑制剂使细胞周期研究能够从实验室带到床边。从最初使用非选择性 CDK 抑制剂的临床试验结果不理想到成功的选择性特异性抑制剂,ER+/HER2-M/ABC 的治疗前景在过去几十年中得到了根本性的发展。针对同一信号通路中的多个成分的新型治疗方式,例如 miRNA 拮抗剂或 miRNA 模拟物,可以帮助肿瘤靶向药物基因检测的应用研究组获得更持久的治疗益处。事实上,靶向多个细胞周期基因转录物的 miR-34 模拟物 MRX34 最近进入了临床 I 期评估。然而,耐药性和增加的成本需要开发更多的治疗策略和合理的设计。CDK4/6抑制剂与其他化合物联合用于不同亚型BC的辅助治疗值得更多关注。
- 【佳学基因检测】乳腺癌的种类有哪些?基因检测如何找到靶向药物?...
- 【佳学基因检测】乳腺癌基因检测的方法改进...
- 【佳学基因检测】乳腺癌的基因检测中的WGS检测优势...
- 【佳学基因检测】乳腺癌和卵巢癌风险的BRCA基因检查...
- 【佳学基因检测】肿瘤基因解码筛选卵巢转移基因用于检测...
- 【佳学基因检测】 卵巢癌基因检测的临床意义...
- 【佳学基因检测】乳腺癌早期基因检测HER2阳性辅助治疗:Peruzumab和Trastuzumab...
- 【佳学基因检测】马吉妥昔单抗Margetuximab与曲妥珠单抗在经治基因检测ERBB2 阳性晚期乳腺癌患者中的疗效...
- 【佳学基因检测】靶向药物Enhertu与乳腺癌的精准治疗基因检测...
- 【佳学基因检测】靶向药物Abemaciclib 和阿那曲唑有效抑制HR+/HER2-乳腺癌的临床基因检测应用...
- 【佳学基因检测】靶向药物Alpelisib加氟维司群治疗PIK3CA突变、激素受体阳性、EGFR-2阴性晚期乳腺癌...
- 【佳学基因检测】三阴性乳腺癌的靶向药物戈沙妥珠单抗基因检测...
- 【佳学基因检测】替索单抗Tisotumab宫颈癌靶向药物基因检测...
- 【佳学基因检测】复发性宫颈癌不同的基因检测对靶向药物派姆单抗的反应...
- 【佳学基因检测】乳腺癌与来曲唑靶向药物基因检测临床应用效果案例...
- 【佳学基因检测】三阴性乳腺癌如何通过基因检测增加对靶向药物氟维司群的敏感性...
- 【佳学基因检测】可用于区分阿那曲唑和依西美坦对早期乳腺癌患者的疗效基因检测位点:有证据来源...
- 【佳学基因检测】基因位点分型检测是否可以为乳腺癌复发风险患者选择替代性靶向药物...
- 【佳学基因检测】基因检测揭示影响西妥昔单抗和avelumab 对非小细胞肺癌患者中肿瘤治疗效果...
- 【佳学基因检测】复发性子宫内膜癌基因检测后的PARPi talazoparib 和 PD-L1i avelumab 联合治疗...
- 【佳学基因检测】中国卵巢上皮性癌维持治疗指南标准及基因检测要求...
- 【佳学基因检测】如何确定乳腺癌治疗效果和转移恶化的基因并用基因检测结果指导治疗...
- 【佳学基因检测】基因解码对卵巢癌患者BRCA1/BRCA2基因检测结果的分析...
- 【佳学基因检测】进行卵巢癌BRCA1/2基因检测效果的分析评价结果...
- 【佳学基因检测】进行卵巢癌BRCA1/2基因检测效果的分析评价方法...
- 【佳学基因检测】女性卵巢癌患者是否都应当作 BRCA 种系突变基因检测?...
- 【佳学基因检测】乳腺癌miRNA基因检测...
- 【佳学基因检测】一种利用下一代测序进行差异甲基化基因座的基因检测方法...
- 【佳学基因检测】21 基因复发评分基因检测与早期乳腺癌患者发生转移的临床风险相关的使用和影响...
- 【佳学基因检测】基因检测如何从外周血细胞得知乳腺癌的存在?病例与健康对照大人群研究...
- 来了,就说两句!
-
- 最新评论 进入详细评论页>>



