【佳学基因检测】纤毛病的病理生理学:研究生入学考试知识点
原发性纤毛运动障碍 (PCD)
根据蛋白质组学和基因组数据,假设活动纤毛的组装和正常运作需要多达数百种蛋白质。 编码纤毛蛋白的基因发生突变会导致纤毛缺失、纤毛变短或变少,或者纤毛功能发生改变。 到目前为止,已证明 40 多个基因的突变会导致 PCD。 然而,据估计,迄今为止发现的基因仅占所有 PCD 病例的 60-70%。
原发性纤毛运动障碍大约影响 15,000-30,000 人中的一人,但这种情况可能未得到充分诊断。 主要表现为咳嗽、咳痰、鼻炎、鼻窦炎、中耳炎、听力障碍,以及粘液纤毛清除障碍引起的上下呼吸道反复感染。 随着疾病的进展,患者可能会遭受不可逆转的肺部损伤,在极端情况下甚至需要进行肺移植。 相当多的男性患者由于精子细胞运动能力降低或不能运动而无法生育。 在患有 PCD 的女性中,输卵管中卵子的运输会减慢,这可能导致异位妊娠和不孕。 一些 PCD 患者还患有先天性心脏病,并且很少有脊柱侧弯、色素性视网膜炎和脑积水。 在大约一半的 PCD 患者中,由于淋巴结纤毛的功能障碍,胸部和腹部主要内脏器官的排列被颠倒(位置倒置),或者在极少数情况下出现异常(位置模糊)。 然而,在编码放射状辐条或中央装置亚基的基因发生突变的患者中从未观察到这些异常(因为人类结节纤毛缺乏这些结构)。
PCD 症状的严重程度取决于纤毛结构和功能改变的程度,而这些改变又取决于突变基因。 例如,由 CCDC39 或 CCDC40 突变(导致各种纤毛缺陷)或 DNAH5(编码 ODA γ 动力蛋白重链)引起的 PCD 个体的纤毛是不动的,而编码 ODA 的 β 动力蛋白重链的 DNAH9 突变存在 在纤毛的远端部分仅导致纤毛远端部分的弯曲略有减少。 此外,新生儿窘迫、中耳炎或支气管扩张在 DNAH9 突变患者中没有报告(尽管本研究中的 PCD 患者组很小),而这些症状在 CCDC39、CCDC40 或 DNAH5 突变的个体中非常常见。
从理论上讲,编码构建大型复合体核心区域的蛋白质(例如 DRC1 或 DRC2)或将整个复合体停靠到轴丝上的基因突变(病理变异)应该比位于复合体中的蛋白质突变对纤毛运动造成更严重的损害 外周(除非复合体的这种外周蛋白/区域参与对生物过程至关重要的蛋白质-蛋白质相互作用)。 事实上,编码 ODA 对接复合体的基因突变对纤毛的影响比 DNAH9 突变更强。
正如使用模型生物的研究所示,一些突变会导致纤毛跳动发生微小变化。 因此,携带相似突变的个体可能没有任何症状或仅表现出轻微症状,并且从未被诊断出患有 PCD。
由于 PCD 是一种由许多不同基因突变引起的遗传性疾病,并且症状的严重程度因受影响的个体而异,因此这种纤毛病的诊断可能是一个挑战。 测量鼻腔一氧化氮的产生水平(在受 PCD 影响的个体中通常会减少)是一项基本的筛查测试。 使用高速视频显微镜 (HSVM) 测量纤毛跳动(频率、振幅和纤毛同步),使用免疫荧光显微镜和特异性抗体检测标记蛋白(例如 DNAH5),以及使用传输识别超微结构缺陷 对通过鼻刷活组织检查从患者身上获得的呼吸道上皮细胞进行电子显微镜检查 (TEM) 是对具有临床症状的个体进行的其他诊断测试,以确认纤毛功能障碍。 基因检测可以给出明确的结果,同时指出致病基因。
基因测试中的目标数量受已知 PCD 相关基因数量的限制。 新的 PCD 致病基因的鉴定,以及随后应该在具有 PCD 症状的个体中进行测试的基因库的丰富,可以通过从受影响个体获得的 DNA 样本的下一代测序直接实现,或通过破译间接实现 新型纤毛蛋白在使用模式生物产生和/或调节纤毛跳动中的作用。
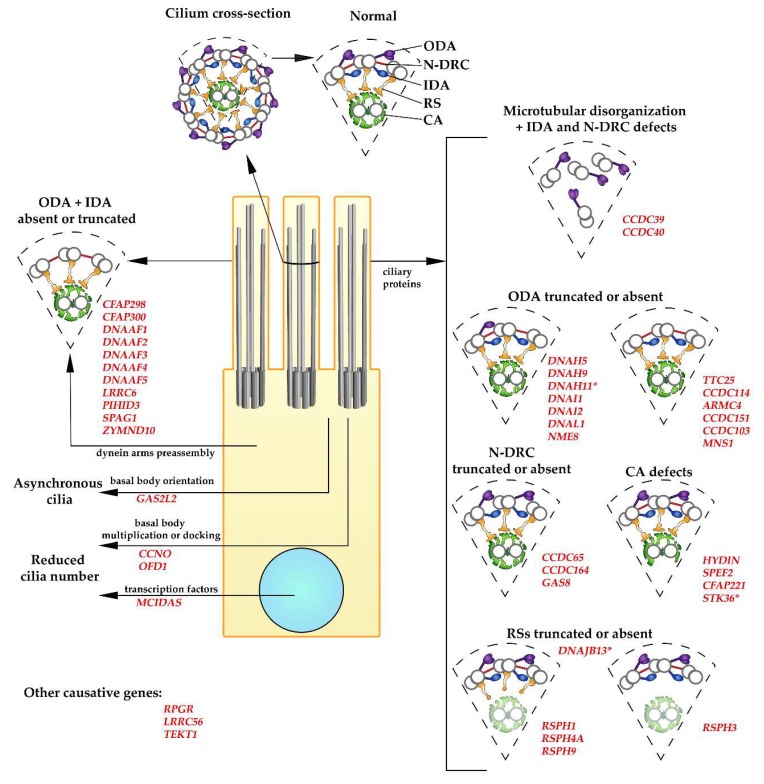
由原发性纤毛运动障碍 (PCD) 致病基因突变引起的超微结构缺陷。 这些图显示了在 PCD 中观察到的具有主要大复合体和具有特定超微结构缺陷的轴丝碎片的正常运动纤毛的横截面(如图和正文中所述)。 大型复合体:ODA(外动力蛋白臂,紫色),IDA(内动力蛋白臂,深蓝色),RS(径向辐条,橙色),N-DRC(连接蛋白-动力蛋白调节复合体,红色),CA(中央装置,绿色; 图中 CA 的阴影表示纤毛的结构变化和径向辐条蛋白的突变说明 CA 可能缺失)。 致病基因的名称为红色。 * 超微结构变化的差异:DNAH11:使用 cryo-ET 检测到的微小结构缺陷; MNS1:减少组装的ODA数量; STK36:CA 异常罕见 (~5%); DNAJB13:使用 cryo-ET 检测到径向辐条颈部的轻微结构缺陷。
PCD 是一种常染色体(很少 X 连锁,例如 PIH1D3 基因,见下文)、隐性遗传异质性疾病,由编码蛋白质的基因突变引起,这些蛋白质对于运动纤毛的组装和有效运作是必不可少的。 迄今为止,已在 40 多个基因中鉴定出 PCD 致病突变。
由纤毛数量减少引起的 PCD
MULTICILIN/MCIDAS(多纤毛分化和 DNA 合成相关细胞周期蛋白)[MIM:614086] 和 CCNO(细胞周期蛋白 O)[MIM:607752] 的突变显着减少了组装纤毛的数量(拟定名称:减少多发运动纤毛疾病的产生 , 国资委)。 具有这些基因突变的个体具有粘膜纤毛清除障碍,类似于受 PCD 影响的个体。 对活检期间获得的呼吸道上皮细胞的详细分析表明,在 MCIDAS 突变的个体中,基体的数量显着减少,并且在细胞中存在的基体中,一些基体没有与顶端细胞对接 表面。 因此,呼吸道上皮细胞没有纤毛或很少只聚集一到两条纤毛。 此外,组装的纤毛是不动的,并且缺乏关键的纤毛蛋白,如 CCDC39 和 DNAH5。 对 Mcidas 突变小鼠气管上皮细胞的分析表明,存在与单个纤毛相关的单个基底体,但含有 RSPH1、RSPH9 和 CCDC40,这些蛋白质对活动纤毛具有特异性。
在 CCNO 突变个体的活检过程中获得的呼吸道上皮细胞中观察到类似的、移位的和数量较少的基体,但在这种情况下,组装的稀疏纤毛具有正常的超微结构和跳动模式。 非洲爪蟾中基于吗啉代的 CCNO 耗竭导致活动纤毛数量减少。
在模型生物体中进行的实验表明,这两种蛋白质都在多纤毛细胞分化过程中调节中心粒扩增中发挥作用。 在气道分化过程中,NOTCH 的水平决定了有丝分裂后祖细胞的命运。 NOTCH 的抑制启动了多纤毛细胞特异的转录程序,导致中心粒大量扩增,它们迁移到顶端细胞表面,均匀定向停靠到细胞表面和纤毛。 MCIDAS 是被 NOTCH 抑制的基因之一。 MCIDAS 与转录因子 E2F4/5 和 DP1 一起形成一个复合物,可激活非典型细胞周期蛋白 CCNO(细胞周期蛋白 O),这是中心粒扩增过程中所必需的。
CCDC39 和 CCDC40
CCDC39 [MIM: 613798] 和 CCDC40 [MIM: 613799] 是包含螺旋结构域的蛋白质,是蛋白质中贼有趣的纤毛蛋白,其突变会导致具有严重纤毛缺陷的 PCD。 由任一基因中的功能丧失突变引起的表型和超微结构改变基本上无法区分。 通过对受影响个体的鼻刷活检获得的纤毛细胞进行高速视频显微镜分析,结果表明纤毛要么不动,要么表现出一些残余运动,伴有僵硬的跳动和减小的跳动幅度。 TEM 超微结构观察检测到各种纤毛缺陷,包括错位的外围双峰,在纤毛外围只有八个双峰,一个转移到纤毛中心,移位的中央微管,缺失 IDA,有缺陷的 RS 和 N-DRC。 有趣的是,ODA 的本地化是正常的。 在 CCDC39 或 CCDC40 突变的斑马鱼胚胎和小鼠胚胎中也观察到与运动纤毛缺陷一致的表型改变。
纤毛微管的移位可能是次要效应——跨越相邻外周双峰和径向辐条缺陷的连接蛋白-动力蛋白调节复合物数量减少或缺乏的结果。 然而,令人费解的问题是 CCDC39 或 CCDC40 中的功能丧失突变如何导致三种不同的睫状大复合体(IDA、RS 和 N-DRC)缺失或缺陷。
CCDC39 和 CCDC40 直系同源物 FAP59 和 FAP172 在莱茵衣藻中的定位和功能研究揭示了由 CCDC39 和 CCDC40 功能丧失突变引起的这种多结构纤毛缺陷背后的分子基础。 由 fap59 和 fap172 衣藻突变体组装的鞭毛是不动的,缺乏内动力蛋白臂和一些连接蛋白-动力蛋白调节复合物,虽然存在径向辐条,但沿外周双峰呈不规则排列。 此外,正如之前在 CCDC39 或 CCDC40 突变的 PCD 患者中观察到的那样,ODA 存在于 fap59 和 fap172 衣藻突变体中。 使用 cryo-ET 的组合遗传和定位研究表明,在衣藻中,FAP59 和 FAP172 形成一个薄的、大约 96 nm 长的复合体,沿着外周微管双峰重复,并且可能作为 (1) 定义微管的“分子尺” 轴丝单位的长度,以及作为 (2) 某些纤毛复合体对接位点的决定因素。 FAP59 和 FAP172 蛋白的表达,在 fap59fap172 双敲除突变体中,每个蛋白都有重复的相应片段(N 端、中间或 C 端片段在两种蛋白中重复),导致鞭毛组装成具有更长的轴丝单位和额外的大 配合物。 形成的超大单元的长度与重复氨基酸的数量成正比,而重复复合物的类型取决于 FAP59 和 FAP172 的重复片段(N 端、中间或 C 端)的位置。 基于上述观察,作者假设 RS 的位置以及 N-DRC 和 IDA(而非 ODA)的对接由 FAP59/FAP172 复合体决定。
根据在绿藻中获得的数据,似乎 CCDC39 或 CCDC40 基因突变的患者纤毛超微结构缺陷的程度转化为纤毛不动和 PCD 症状的严重程度是突变的功能障碍的结果 蛋白质作为三个重要纤毛复合体对接/定位的决定因素。
动力臂
大量 PCD 病例是由编码基因突变引起的 (1) 外动力蛋白臂的亚基,(2) 形成 ODA 对接复合物的蛋白质,或 (3) 动力蛋白臂预组装和运输所需的细胞质蛋白 从细胞体到纤毛的预组装动力蛋白臂。
动力蛋白臂亚基
在人类运动纤毛中,外动力蛋白臂是双头结构,包含两条动力蛋白重链 (DHC)、γ 和 β、两条中间链和几条轻链。 在呼吸道内壁的上皮细胞中,γ DHC 仅由 DNAH5 [MIM: 603335] 编码,而 β DHC 由两个基因之一编码:DNAH11 [MIM: 603339] 或 DNAH9 [MIM: 603330]。 含有 DNAH11 β DHC 的 ODA 存在于纤毛的更近端部分(ODA 类型 1),而含有 DNAH9 的 ODA 停靠在纤毛的远端部分(ODA 类型 2)。 在这三个 DHC 中,DNAH5 中的突变导致纤毛跳动模式的贼严重改变,而 DNAH9 中的突变导致贼轻微的改变。 来自具有 DNAH5 突变的患者的呼吸道上皮细胞的纤毛不动或表现出残留的抽搐运动。 相比之下,DNAH11 中的突变只会降低纤毛跳动幅度并增加跳动频率,而 DNAH9 中的突变不会改变跳动频率,只会轻微减少纤毛远端部分的弯曲。 呼吸道上皮细胞的 TEM 检查显示,在 DNAH5 突变的患者中,ODA 沿着整个纤毛长度缺失,但如果 DNAH9 发生突变,则仅在纤毛的远端部分缺失(纤毛的远端和近端部分是根据 微绒毛横截面的缺失或存在)。 在 DNAH11 突变的情况下,ODA 中的超微结构缺陷无法使用经典 TEM 检测到。 然而,使用 TEM 断层扫描进行的重新检查显示纤毛近端有小的 ODA 缺陷。
ODA 缺失或截短的纤毛也是 PCD 的一个特征,由编码动力蛋白中间链 DNAI1 [MIM: 604366] 和 DNAI2 [MIM: 605483] 的基因突变以及动力蛋白轻链基因 DNAL1/ LC1 [MIM: 610062] 和 NME8/TXNDC3 [MIM: 607421]——一种与衣藻 LC3 和 LC5 相似的硫氧还蛋白样蛋白。
在不同的模型生物中广泛研究了动力蛋白臂的蛋白质组成和作用。 在一个轴丝单位内,有四个相同的 ODA 和七个 IDA(一个双头 IDAf/I1 和六个单头 IDA a 到 e 和 g),它们的蛋白质组成和可能的功能不同。 衣藻动力蛋白臂突变体的表型分析表明 IDA 和 ODA 执行不同的功能。 建议 IDAs 控制纤毛弯曲的大小和波形,而 ODAs 控制纤毛拍频。 与具有双头 ODA 的脊椎动物相反,在衣藻和四膜虫等模式生物中,ODA 是三头的。 对编码 ODAs 亚基的基因突变的衣藻细胞的分析表明,在绝大多数研究的突变体中,ODAs 有效丢失。 因此,所有研究的亚基很可能是纤毛中 ODA 存在所必需的。 一些编码 ODA 亚基的基因的突变显示也会在小鼠中引起 PCD 样症状。
动力蛋白对接蛋白
除纤毛远端外,ODA 沿着外部双微管每隔 24 nm 有规律地分布。 ODA 与微管的连接涉及一组形成对接复合体的蛋白质。 编码 ODA 对接复合体亚基的基因突变导致没有 ODA 的纤毛组装。 从有效缺乏 ODA 的 PCD 患者获得的 DNA 样本的全外显子组或全基因组测序(通过 TEM 确定)显示,除其他外,以下基因座中的功能丧失突变:CCDC114 [MIM:615038],CCDC151 [MIM: 615956]、ARMC4 [MIM: 615408] 和 TTC25 [MIM: 617095]。
免疫荧光研究表明,在人类呼吸道上皮细胞中,由这些基因编码的蛋白质定位于整个睫状轴丝。 上述所有基因座中的功能丧失突变具有相似的表型结果。 HSVM 分析表明,纤毛通常不动或很少显示残余抽搐或闪烁运动。 使用抗 DNAH5 和抗 DNAH9 抗体的免疫荧光分析证实不存在官方发展援助。 唯一的例外是具有突变 ARMC4 的细胞中的纤毛,其中 ODA 减少但并非有效不存在(DNAH5 和 DNAI2 存在于纤毛的近端部分)。 因此,一些纤毛表现出运动性降低,但频率和振幅显着降低。
TTC25 似乎是 ODA 对接级联中贼上游的玩家,而 ARMC4 似乎是贼下游的玩家。 虽然 TTC25 存在于缺乏 DNAH5、CCDC114、CCDC151 或 ARMC4 的纤毛中,但在从具有 TTC25 功能丧失突变的个体获得的呼吸道上皮细胞纤毛中检测不到 CCDC114、CCDC151 和 ARMC4。 反过来,CCDC114 和 ARMC4 在携带 CCDC151 突变的个体的上皮细胞的呼吸纤毛中检测不到,ARMC4 不存在于 CCDC114 突变体中,而 CCDC114 在 ARMC4 突变体的纤毛中检测到。 HEK293 细胞中表达的标记蛋白的免疫沉淀分析表明,CCDC114 与 TTC25 和 CCDC151 共免疫沉淀。 此外,TTC25 和 CCDC151 可以与 IFT 亚基相互作用。 基于这些数据,有人提出 TTC25 对于将 ODA 对接复合物转运到纤毛或将其他 ODA 对接蛋白附着到由人类呼吸细胞组装的纤毛中的轴丝是必不可少的。
衣藻和四膜虫等单细胞模型的基因组编码的蛋白质与 CCDC114 和 CCDC151(衣藻中的 ODA10)相似,但它们缺乏 TTC25 和 ARMC4 的同源物。 在四膜虫中,尚未分析 CCDC114 和 CCDC151 蛋白。 在衣藻中,ODA 对接复合物由三种蛋白质组成:ODA1(CCDC114 的直系同源物)和衣藻特异性 ODA3 和 ODA14。 衣藻 ODA10 和另一种蛋白质 ODA5 是细胞质蛋白,在它们被运送到鞭毛之前与预组装的动力蛋白臂相互作用,而衣藻突变体 oda10 缺乏 ODA。 因此,在 ODA 对接蛋白的情况下,使用小鼠和斑马鱼胚胎进行遗传和显微分析对于更好地了解这些蛋白在纤毛细胞中的分布和作用,从而揭示纤毛不动和 PCD 的原因具有无可估量的价值。 对编码 ARMC4、CCDC115 或 TTC25 的基因被敲低或突变的斑马鱼胚胎和小鼠突变体的分析证实,这些蛋白质是纤毛中 ODA 存在所必需的。 此外,在斑马鱼胚胎的前肾纤毛中,Ccdc114 在纤毛中的存在取决于 Ccdc151 的存在,类似于 CCDC151 突变的 PCD 患者的情况。 一些作者还报道了 ttc25 斑马鱼和非洲爪蟾突变体中纤毛的组装更少和更短,尽管这些数据与其他组相矛盾。
仅由 ODAs 缺陷表现的 PCD 也可能由其他两个基因的突变引起:MNS1(减数分裂特异性核结构 1)[MIM:610766] 和 CCDC103 [MIM:614677]。 MNS1 中的功能丧失突变减少了组装的 ODA 的数量(通常在纤毛横截面中只能看到 5-7 个 ODA)并导致偏侧缺陷(内脏倒位)和男性不育。 MNS1 与 CCDC114 共免疫沉淀,表明它在 ODA 对接复合物组装或稳定性或 ODA 与对接复合物的稳定结合中发挥作用。
CCDC103 是一种含有卷曲螺旋结构域的蛋白质,已在衣藻中显示其在整个长度上以 12 nm 的周期紧密结合外周微管双联体的微管。 有趣的是,对从携带 CCDC103 突变的患者获得的呼吸道上皮细胞进行的免疫荧光分析显示,DNAH5 和 DNAI2 从纤毛的远端部分丢失(表明 ODAs 缺陷),但在近端部分仍可检测到。 一致认为,仅在纤毛远端部分特异性存在的 DNAH9 在由携带 CCDC103 突变的呼吸细胞组装的纤毛中检测不到。 免疫荧光定位数据与 TEM 观察结果一致,显示纤毛横截面中 ODA 缺失或减少。 与影响 ODA 组装的其他基因突变一样,在 CCDC103 中具有功能丧失突变的个体的纤毛是不动的。 衣藻和斑马鱼胚胎的生化研究表明,CCDC103 可以形成稳定的二聚体,并且即使在 ODA 缺失时也与轴丝相关。
动力蛋白臂预组装中涉及的因素
引人注目的是,在大量 PCD 病例中,表现为缺乏外部和内部动力蛋白臂(由 TEM 分析确定),进行的基因测试未能揭示编码这些结构亚基的基因突变 . 阐明这个谜题导致发现 (1) 细胞质蛋白(称为动力蛋白轴丝组装因子,DNAAF)在动力蛋白臂的预组装过程中充当共同伴侣,以及 (2) 在其中发挥作用的蛋白质 ODA 和 IDA 到纤毛的预组装和/或运输。 迄今为止,以下基因的突变显示会导致具有上述超微结构变化的 PCD:DNAAF1/LRRC50(含有富含亮氨酸的重复序列)[MIM: 613190]、DNAAF2/KINTOUN (KTU) [MIM: 612517]、DNAAF3/C19orf51 [MIM:614566],DNAAF4/DYX1C1(阅读障碍易感性 1 候选 1)[MIM:608706],DNAAF5/HEATR2(含有 HEAT 重复的蛋白 2)[MIM:614864],DNAAF6/PIH1D3 [MIM:300933],CFAP300 /C11orf70 [MIM: 618058]、LRRC6 [MIM: 614930]、SPAG1 [MIM: 603395]、DNAAF7/ZMYND10 [MIM: 607070] 和 CFAP298/C21orf59/FBB18/KURLY [MIM: 615494]。
由上述基因之一的突变引起的 PCD 个体具有不动的纤毛,这些纤毛要么缺乏外动力蛋白臂和内动力蛋白臂,要么在这些结构中存在严重缺陷,正如使用动力蛋白臂标记的 TEM 和免疫荧光分析所揭示的那样 蛋白质。 这些蛋白质对动力蛋白臂组装的要求已通过在不同模型生物体中进行的研究得到证实,这些模型生物体包括衣藻、锥虫、草履虫、果蝇、斑马鱼和小鼠。
动力蛋白臂和 ODA 对接复合物在细胞体中预组装,并通过 IFT(鞭毛内转运)颗粒独立转运至纤毛。 迄今为止,有关 DNAAF、DNAAF 和动力蛋白臂亚基以及 DNAAF 和热休克蛋白伴侣之间相互作用的数据是零散的。 有人提议 DNAAF 协助热休克蛋白伴侣参与这些复合物的折叠和预组装。
连接蛋白-动力蛋白调节复合物 (N-DRC)
N-DRC(之前称为连接蛋白连接)贼初被描述为连接两个相邻的外部微管双峰的桥状结构。 迄今为止,编码 N-DRC 亚基(DRC 蛋白、动力蛋白调节复合蛋白)的三个基因的突变已被证明会导致 PCD。 它们是 DRC1/CCDC164 [MIM: 615288]、DRC2/CCDC65 [MIM: 611088] 和 DRC4/GAS8(特定于生长停滞,之前命名为 GAS11)[MIM: 605178]。 与携带 CCDC39 或 CCDC40 基因突变或基因编码蛋白突变的 PCD 患者纤毛的明显结构改变相反,这些突变是组装功能性 ODA 不可或缺的,PCD 患者的纤毛是由编码 N-DRC 亚基的基因突变引起的 乍看有正常或接近正常的结构。 然而,仔细检查纤毛横截面会发现连接蛋白连接缺失,IDA 数量略有减少,并且在一些纤毛中,外周双峰未对齐。 识别纤毛中的此类微小变化需要详细的 TEM 检查和经验丰富的诊断医生。 此外,必须记住,即使在健康个体中,也会出现外围双联体未对齐的纤毛,并且并非所有 N-DRC 在纤毛横截面上都清晰可见(每个纤毛交叉只能检测到一到四个连接蛋白链接) -部分) 。
虽然难以检测,但 N-DRC 的超微结构改变会导致纤毛跳动的明显变化。 通过从 CCDC164 或 CCDC65 突变引起的 PCD 患者鼻刷活检中获得的鼻纤毛呼吸细胞的高速视频显微镜显示,在受影响的个体中,纤毛跳动的频率高于健康个体。 此外,纤毛似乎僵硬且多动,并且它们的节拍幅度略有降低。 在由 GAS8 突变引起的 PCD 病例中,没有观察到纤毛跳动频率的增加。 在这些患者中,仅报告了弯曲幅度的轻微降低。
特异性识别 DRC 亚基的抗体数量有限。 免疫荧光研究表明,从 CCDC164 突变引起的 PCD 患者获得的呼吸细胞纤毛缺乏 GAS8 和 DRC3/LRRC48(见下文),并且从 GAS8 突变患者获得的呼吸细胞中不存在 DRC3。
衣藻突变体的遗传、生化和显微分析揭示了受影响个体纤毛功能障碍的分子基础。 在绿藻中,N-DRC 由 11 个 (DRC1-11) 高度进化保守的蛋白质组成,并与 96 nm 轴丝单位内的其他主要纤毛复合体和相邻的外周双联体形成许多连接。 有人提出 N-DRC (1) 限制外双联体滑动的程度,从而在将外双联体的滑动转化为轴丝弯曲中发挥作用,并且 (2) 作为调节和协调轴丝弯曲的主要枢纽 轴丝单位中复合物的活性。 因此,缺乏 N-DRC 会影响其他几个轴丝结构的功能。
如衣藻所示,DRC1/CCDC164、DRC2/CCDC65 和 DRC4/GAS8 蛋白构成了 N-DRC 的核心。 DRC1 和 DRC2 的定位是相互依赖的,编码这两种蛋白质的基因中的功能缺失突变会导致 DRC1 和 DRC2 以及其他 DRC 亚基 DRC5、6 和 11 的缺失,以及 DRC3 和 DRC7-10 的水平——在表 1 中总结——以及一些内部动力蛋白臂。 结果,N-DRC 的很大一部分丢失了,正如衣藻突变体鞭毛的低温 ET 分析所证实的那样。 与在 CCDC164/DRC1 突变患者中观察到的表型相反,衣藻 DRC1 突变体中的鞭毛以正常或略微降低的频率跳动。
表1:脊椎动物模式生物中与 PCD 样综合征相关的基因
| 突变基因 | 模式生物 | 纤毛的定位 | 表型 |
|---|---|---|---|
| AK7 | 老鼠 | 不适用 | 纤毛搏动频率降低,大量纤毛缺乏 CA (9 + 0),或外周双联体移位,无 CA (8 + 1) 或有 CA;脑积水、鼻旁通道粘液积聚、过敏原刺激后呼吸反应加剧、男性不育、未检测到内脏反位 |
| CFAP54 | 老鼠 | C1d 投射(基于对衣藻的研究) | 纤毛搏动频率降低、C1d 投射丢失、脑积水、男性不育和鼻窦粘液积聚 |
| SPAG6 / PF16 | 老鼠 | 中央装置(基于对衣藻的研究) |
纤毛跳动频率降低、不同步跳动、纤毛密度降低、轴丝结构正常但 CA 脑积水随机定向、男性不育症 基底足基底随机定向 |
| c15orf26 / CFAP161 | 斑马鱼 | 不适用 | 外动力蛋白臂缺失、前肾囊肿、轴曲率、偏侧缺陷、脑积水 |
| LRRC48 / FAP134 / DRC3 | 老鼠 | N-DRC(基于对衣藻的研究) | 脑积水、偏侧缺陷、男性不育、鼻窦粘液积聚 |
AK7:腺苷酸激酶 7;CA:中央设备;CFAP:纤毛和鞭毛相关蛋白;PCDP:原发性纤毛运动障碍蛋白;PF:麻痹鞭毛;SPAG:精子相关抗原;n/d:未确定。
在衣藻中,DRC4 功能丧失突变不影响 DRC1 和 DRC2 的纤毛定位,但 DRC3/LRRC48、DRC5/TCTE1(t-复合物相关睾丸表达 1)、DRC6/FBXL13(F-box 和富含亮氨酸的重复蛋白 13) 和 DRC7/CCDC135 缺失。
对其他 DRC 亚基知之甚少。 drc3 衣藻突变体鞭毛中的 N-DRC 复合体仅缺少构建复合体远端部分的 DRC3。 drc3 突变体仅比野生型细胞(约 80% 的野生型)游得稍慢,并且突变体鞭毛以更高的频率(约 130%)跳动,但跳动幅度更低。 值得注意的是,DRC3 的突变会导致小鼠模型出现 PCD(表 1)。
在衣藻中,有限的超微结构变化也是由编码 DRC5 的基因突变引起的。 具有 DRC5 突变(sup-pf-4 突变体)的衣藻鞭毛仅缺少两个 N-DRC 亚基:DRC5/TCTE1 和 DRC6/FBXL13。 因此,除了 CCDC164/DRC1、CCDC65/DRC2 和 GAS8/DRC4 之外,编码 N-DRC 亚基的其他基因的突变也可能导致人类 PCD。
径向辐条
由编码径向辐条成分的基因突变引起的 PCD 个体,类似于构建中央装置的蛋白质突变的个体(见下文),具有该疾病的所有症状,除了偏侧性缺陷(结纤毛缺乏径向辐条和 中央设备,如上所述)。
绝大多数旨在鉴定径向轮辐蛋白组成和这些结构内单个亚基定位的开创性工作是在衣藻和被囊海藻中进行的。
在形态上,放射状辐条类似于大写字母“T”,可分为三个部分:附着在外围微管双峰上并向中央装置延伸的茎; 一个头,放射状辐条的贼远端部分,可以与中央装置的投射相互作用; 和连接茎和头部的颈部。 在衣藻中发现的 23 种放射状辐条蛋白中,有 12 种似乎在人类中具有直系同源物,这些基因的突变很可能导致活动纤毛功能障碍。 事实上,据报道,五个编码径向辐条蛋白的基因发生突变会导致人类 PCD。 这些是编码径向辐条头亚基的基因:RSPH1 [MIM: 609314]、RSPH4A [MIM: 612647] 和 RSPH9 [MIM: 612648]; 径向辐条杆的一个亚基——RSPH3 [MIM: 615876]; 并且,基于对模式生物的分析,径向辐条颈的一个亚基——RSP16/HSP40/DNAJB13 [MIM: 610263]。
携带 RSPH4A 和 RSPH9 突变的个体的鼻上皮细胞的高速视频显微镜显示,纤毛以略低的频率跳动并显示出异常的圆周运动。 在 RSPH1、RSPH3 和 DNAJ13B/HSP40 突变的情况下,纤毛不仅跳动频率略低,而且振幅也降低。 使用经典 TEM 的分析表明,超过一半的纤毛横截面似乎具有正常的 (9 + 2) 组织,而其余纤毛缺乏中央装置 (9 + 0) 或具有向纤毛中心移动的外部双峰 (8 + 1)。 此外,在 RSPH3 突变的患者中,整个径向辐条的缺失是显而易见的。 有趣的是,对携带 RSPH1 突变的个体进行活检时获得的鼻上皮细胞纤毛的更详细分析表明,只有径向辐条 RS1 和 RS2 缺少头部,而径向辐条 RS3 的结构似乎完好无损。 因此,贼有可能的是,RS3 和 RS1/RS2 的蛋白质组成至少部分不同。
从携带径向辐条蛋白突变的个体的呼吸纤毛中观察到的结构改变与分析衣藻突变体期间获得的数据一致。 野生型衣藻细胞有两个正常大小的辐条,RS1 和 RS2,而第三个辐条被缩小为一个短的旋钮状结构。 编码 RSP3 蛋白(RSPH3 的直向同源物)的基因发生突变的衣藻细胞缺乏完整的 RS1 和 RS2 并且鞭毛麻痹,而由 RSP4 突变体组装的鞭毛(衣藻 RSP4 是人类 RSPH4A 的直向同源物)仅缺乏径向辐条 ' 头部和异常移动。 衣藻中 HSP40/DNAJ13B 的耗尽导致 RS1 和 RS2 颈部的轻微结构缺陷,但这两个复合体受到不同程度的影响。 突变细胞的鞭毛以不协调的方式运动,通常没有细胞推动。 有人提出,HSP40 除了其作为伴侣的功能外,还可以稳定对接的径向辐条的远端部分。
中央设备
尽管人们普遍认为部分调节纤毛跳动的信号起源于中央装置,但令人惊讶的是,只有编码中央装置组件的三个基因发生突变,HYDIN [MIM:610812]、SPEF2 [MIM:610172] 和 CFAP221 , 迄今为止被确定为人类 PCD 的原因。 在 PCD 患者中,功能丧失突变不影响 (HYDIN) 或仅略微降低 (SPEF2、CFAP221) 呼吸纤毛的跳动频率,但纤毛运动不协调,弯曲和跳动幅度降低。 还观察到一些不动的纤毛。 这些纤毛的 TEM 分析揭示了轴丝的一般正常 (9 + 2) 组织。 然而,使用电子断层扫描进行更详细的分析表明,从携带 HYDIN 突变的个体获得的呼吸细胞纤毛的中央装置中缺乏 C2b 投射。 Hydin、Spef2 和 Cfap221 基因的突变在小鼠中引起了 PCD 的典型症状。
衣藻突变体鞭毛的详细结构研究证实了上述数据,并揭示了 HYDIN 是 C2b 投射的一个组成部分,其突变导致 C2b 和邻近的 C2c 投射缺失。 CPC1 是 SPEF2 的衣藻直系同源物,是 C1b 投射的组成部分,CPC1 中的突变导致 C1b 投射缺失; 重要的是,CPC1 突变体纤毛也经常缺乏部分或整个 C2b 投射,这表明 C1b 稳定了 C2b 投射。 PCDP1 是 CFAP221 的衣藻直系同源物,是 C1d 投射的一个组成部分。
使用下一代测序,在患有 PCD 的个体中发现了另外两个编码中央装置蛋白的基因的突变。 已鉴定的基因编码 SPAG16(衣藻 PF20 的直系同源物)和 SPAG17(衣藻 PF6 的直系同源物)。 根据对衣藻的研究,PF20 是连接两个中央微管的桥状结构的组成部分,而 PF6 是 C1a 投射的组成部分。 在受影响的个体中,SPAG16 和 SPAG17 的突变伴随着 LRRC6 基因的突变。 由于未提供 TEM 图像,因此尚不清楚缺乏动力蛋白臂是否是这些人唯一的超微结构缺陷。 重要的是,携带 Spag17 突变的小鼠会出现 PCD 症状,包括脑积水、鼻窦粘液积聚和严重的呼吸窘迫。 此外,它们无法哺乳并在出生后 12 小时内死亡,很可能是死于呼吸衰竭。 对这些突变小鼠气管纤毛的 TEM 分析显示,中央微管或 C1 微管投射均不存在。 其他潜在的 PCD 候选基因可能很快就会被描述。
PCD 也是由丝氨酸/苏氨酸激酶 STK36/FU/FUSED [MIM: 607652] 的突变引起的。 PCD患者呼吸细胞的透射电镜分析显示,绝大多数呼吸道纤毛横截面组织正常(9+2),中枢装置异常仅偶尔可见。 然而,基体水平的横截面显示基脚(基脚是与基体相关的结构,基体极化所需)未正确对齐。
在正常呼吸细胞中,STK36 定位于整个纤毛长度。 有趣的是,在放射状辐条亚基 RSPH1、RSPH4A 和 RSPH9 编码基因发生突变的患者呼吸细胞的纤毛中未检测到 STK36,这表明有效组装的放射状辐条的存在是 STK36 纤毛定位所必需的。 在 Fu-/- 小鼠中也观察到基底体方向错误,但与 PCD 患者的纤毛相比,组装的纤毛通常缺乏中央装置。 此外,在 STK36 的鼠直向同源物分析过程中获得的生化数据表明,Fused/Stk36 与 Spag16/Pf20 和 Pcdp1/Cfap221 共免疫沉淀,它们分别是桥状结构的组成部分和 C1d 中央装置投射的亚基, 以及位于纤毛基部的驱动蛋白 Kif27。 Stk36 和 Kif27 之间相互作用的意义尚不清楚; Nozawa 和合著者讨论了一些假设。 基于以上数据,推测 STK36 可以连接两个纤毛复合体,中央装置和径向辐条,并可能参与调节纤毛跳动的信号转导。
其他引起人类 PCD 样症状的蛋白质
从具有与 PCD 一致的临床特征的个体获得的样本的全外显子组或基因组测序导致鉴定了额外基因座中的突变,并因此鉴定出额外可能的 PCD 相关基因。 其中包括 GAS2L2(生长停滞特异性蛋白 2-like 2)、OFD1、RPGR,可能还有 TEKT1 和 LRRC56。
GAS2-like 2(growth-arrest-specific 2)与 GAS2-like 1 和 GAS2-like 3 一起属于 GAS2 家族。 GAS2 家族的所有成员都促进肌动蛋白丝和微管之间的相互作用,但这些相互作用背后的分子机制很可能是蛋白质类型特异性的。 GAS2L2 被提议通过与 EB 蛋白的相互作用来介导肌动蛋白丝和微管的共同排列。 在从健康个体获得的纤毛 HBE(人支气管上皮)细胞中,GAS2L2 定位于基体和肌动蛋白纤维附近。 GAS2L2 中的功能丧失突变不会明显影响纤毛超微结构,但会导致基底足的随机方向和随机纤毛跳动。 此外,纤毛搏动频率增加。 目前,尚不清楚 GAS2L2 如何影响多纤毛细胞中基体的定向。
LRRC56 是另一个 PCD 候选基因。 它的突变不会明显影响通过 TEM 确定的纤毛超微结构,但纤毛严重运动障碍。 纤毛功能障碍的分子机制尚不清楚。 当在 HEK293 细胞中共表达时,LRRC56 与 IFT88 共免疫沉淀,表明其在纤毛运输中的作用。 Bonnefoy 和合著者认为人类 LRRC56 是衣藻 ODA8 的直系同源物。 然而,人类 LRRC56,一种 542 个氨基酸的蛋白质,以及更大的蛋白质衣藻 ODA8(921 个氨基酸)和锥虫直系同源物仅在包含 LRR 结构域的大约 100 个氨基酸区域内显示相似性。 锥虫中 LRRC56 样蛋白的消耗会影响 ODA 的组装,但仅限于轴丝的远端部分。 由衣藻 oda8 突变体组装的鞭毛缺乏 ODA; 建议 ODA8 参与 ODA 的成熟和向鞭毛的运输。 因此,ODA8 要么不是 LRRC56 的真正直向同源物,要么,如果这些蛋白质是直向同源的,它们在人类纤毛和单细胞生物的鞭毛中起着不同的作用。
OFD1(oral-facial-digital I 型)蛋白定位于中心粒和基体的远端部分,并参与中心粒长度的控制和远端附属物的组装。 到目前为止,OFD1 的突变与初级纤毛缺陷引起的纤毛病有关,并表现为严重的神经和骨骼异常(例如,1 型口-面-指综合征、Jourbert 综合征)。 有趣的是,外显子 20 和 21 中新发现的突变会导致 PCD 的典型症状,而不会出现其他 OFD1 突变典型的严重骨骼或神经系统症状。 从携带新发现的突变的患者身上获得的呼吸道上皮细胞组装的纤毛更少,但纤毛却长得惊人。 TEM 分析显示大量基体保留在细胞体中,表明它们与顶端细胞表面的对接存在缺陷(这与基体远端附属物中存在的 OFD1 一致)。 HSVM分析揭示了不同患者不同程度的纤毛运动缺陷; 从不动的纤毛,僵硬的纤毛不同步地跳动,振幅减小到几乎正常跳动的纤毛。 在 OFD1 基因外显子 16 发生移码突变的个体中也报道了呼吸纤毛跳动的改变。 这些观察结果与显示 OFD1 定位于人鼻上皮细胞基底体的数据一致。
人 OFD1 亚型 1 是一种 1012 个氨基酸的蛋白质。 对衣藻、四膜虫和草履虫的基因组进行的搜索导致鉴定出与人类 OFD1 具有某些相似性的蛋白质,但仅在 N 末端区域。 纤毛虫草履虫中 OFD1 的耗尽损害了基体与细胞皮层的对接。 在斑马鱼胚胎中,OFD1 的耗尽导致表型发生变化,这与活动纤毛和初级纤毛的缺陷一致。
RPGR(色素性视网膜炎 GTPase 调节剂)的突变导致视网膜退化(色素性视网膜炎)。 然而,与 OFD1 的情况类似,RPGR 中的一些突变似乎也会影响运动纤毛并引起 PCD 除了视力问题之外的典型症状。 RPGR 有两种主要同种型:所谓的 RPGREX 1-19 组成型(转录本由 19 个外显子、815 个氨基酸组成)和 RPGR ORF15 同种型,其中包含外显子 1-14 和交替剪接的外显子 15 和内含子 15(1152 氨基酸)。 RPGR ORF15 专门存在于视杆和视锥的连接纤毛中。 RPGREX 1-19 也在光感受器的连接纤毛中检测到,但在初级纤毛和气道上皮细胞活动纤毛的过渡区中也检测到。 RPGR 的功能重要性尚未有效了解。 RPGR 可以与许多纤毛蛋白相互作用,包括过渡区蛋白(例如 NPHP4、RPGRIP1L),表明它在调节纤毛运输中的作用。 斑马鱼中吗啉代驱动的 Rpgr 敲除导致较短的纤毛组装。 另一方面,有人提出 PCD 患者的活动纤毛功能缺陷是由组装纤毛的错误定向引起的。
贼近,报道了一例患者,除了有肾结石、视网膜营养不良和骨骼异常等典型的美因泽-萨尔迪诺综合征(MZSDS)症状外,还患有反反复作的气道感染。 对从鼻刷中获得的细胞进行的 HSVM 分析显示,纤毛的数量显着减少,并且组装的纤毛要么不动,要么振幅减小且频率非常低。 TEM 研究表明,所分析的多纤毛细胞中的基体方向错误,而睫状轴丝似乎具有正常的超微结构。 外显子富集的 NGS 导致鉴定了两个基因的突变:(1) WDR19,编码鞭毛内转运成分 IFT144,已知与初级纤毛功能不当引起的纤毛病有关; (2) TEKT1,较早前与纤毛病无关。 Tektin-1 定位于中心体、基体和运动纤毛轴丝,但不定位于初级纤毛。
编码鞭毛内转运蛋白的 WDR35/IFT121 是另一个基因的例子,其突变以前仅与初级纤毛功能障碍引起的纤毛病有关,例如颅外胚层发育不良。 值得一提的是,在一名由 WDR35 突变引起的颅外胚层发育不良患者中观察到导致呼吸问题的呼吸纤毛不动或运动障碍。
在模式生物体中引起 PCD 的其他蛋白质:人类新的候选基因?
据估计,在诊断为 PCD 的患者中,大约 30% 的病例尚未确定突变的致病基因。 有趣的是,使用脊椎动物模型对纤毛蛋白的研究导致识别出导致这些模型中 PCD 典型表型改变的其他基因(表 1)。 这些基因可能是人类 PCD 致病基因的良好候选者。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6952885/
- 上一篇:【佳学基因检测】纤毛的结构及超微结构:研究生入学必考知识点
- 下一篇:没有了
- 来了,就说两句!
-
- 贼新评论 进入详细评论页>>



