【佳学基因检测】高蛋氨酸血症基因检测案例
遗传病、罕见病基因检测导读:
根据《代谢异常基因检测》,甲硫氨酸腺苷转移酶 I/III (MATI/III) 缺乏症 (MIM #250850) 是甲硫氨酸遗传性持续升高的最常见原因,由 MAT1A 突变引起。这为基因检测机构提供新生儿基因检测筛查提供了指导。随着通过干血斑分析进行新生儿筛查的出现,1974 年新颖发现甲硫氨酸单独升高而同型半胱氨酸升高,从而排除了胱硫醚 β-合酶缺乏症。根据新生儿筛查数据,单独的蛋氨酸升高的发生率因地理区域而异:一项针对台湾人群的研究显示,在 1,701,591 名新生儿中,有 16 例单独存在高蛋氨酸血症,其中一半以上的 MAT1A 基因突变。另一方面,另外两项针对伊比利亚半岛人口的研究表明,加利西亚和葡萄牙的发病率分别为 1/28,163 和 1/26,000。该病症可以以常染色体显性或隐性方式遗传。隐性形式的特征可能是中枢神经系统异常,主要表现为脑部 MRI 上的白质变化,在 64 名纯合子或复合杂合子突变患者中的 32 名患者中发现了这种变化。 1992 年新颖描述了高甲硫氨酸血症的显性遗传,随后确定是由 MAT1A p.Arg264His 突变引起的。这种主要形式被认为是良性的,甲硫氨酸浓度只有轻度升高。在上述加利西亚系列中,通过新生儿筛查检测到的所有患者都是 p.Arg264His 突变的杂合子。事实上,这种显性突变导致了新生儿筛查检测到的大多数高甲硫氨酸血症病例。值得注意的是,p.Arg264His 突变也见于具有隐性疾病的复合杂合子,无论是否有神经系统异常,据报道单个杂合子具有髓鞘形成异常。
MAT 酶 (EC2.5.1.6) 可以是二聚体 (MAT III) 或四聚体 (MAT I),同源二聚化对其酶活性至关重要。它有两个主要功能,S-腺苷甲硫氨酸 (AdoMet) 合成和三聚磷酸酶 (PPPase) 活性。在两步反应中,ATP 的腺苷基团转移到甲硫氨酸形成 AdoMet 和三聚磷酸盐 (PPPi),然后 PPPi 在不与酶解离的情况下被酶促水解以释放焦磷酸盐和磷酸盐。 AdoMet 是广泛生物过程的主要甲基供体,并且在多胺合成和甲硫氨酸/高半胱氨酸循环的调节中具有功能。对由 p.Arg264His 变体引起的常染色体显性遗传形式的 MATI/III 缺陷的初步调查表明,它会干扰 MAT 亚基形成同源二聚体的能力。已经表明,p.Arg264His 变体产生的酶在大鼠中具有 0.37% 的 AdoMet 合成活性。另一方面,MAT PPPase 活性与野生型 (WT) 相似,被无机焦磷酸盐抑制但不受蛋氨酸或 ATP 刺激,表明底物结合不足。
其他系列报道了孤立性高甲硫氨酸血症患者的 MAT1A 杂合子变化,尽管这些其他变异的遗传模式从未得到阐明。直到最近,人们还假设从未发现 MAT1A 中的第二个变体,或者考虑到与常染色体显性遗传相关的第二个突变的可能性,但由于缺乏亲本检测而从未得到证实。最近,已经描述了额外的杂合 MAT1A 突变,特别是 p.Arg249Gln(6 名患者)和 p.Gly280Arg(1 名患者)也位于二聚体界面附近。两名患有 p.Arg249Gln 突变的患者的父亲也携带了这种替代,并且血浆蛋氨酸水平轻度升高。在此,高蛋氨酸血症基因检测案例描述了一对患有高甲硫氨酸血症的母女,均携带 p.Ala259Val 突变,从而证实了该变异的常染色体显性遗传。
高蛋氨酸血症基因检测案例介绍
来自重庆的患者在 3 周大时接受新生儿筛查,结果显示甲硫氨酸升高呈阳性,需要进行再次评估并考虑是否需要做基因检测。她在妊娠 40 周时通过自然阴道分娩出生。出生体重为 3.205 公斤。她是母乳和配方奶喂养的。她出生后第 1 天的新生儿筛查显示甲硫氨酸浓度为 0.81 mg/dL(54 μmol/L),截止值 < 0.8 mg/dL,在出生第 16 天收集的重复样本显示甲硫氨酸浓度为 1.08 mg /dL(73 μmol/L)。初始同型半胱氨酸为 8.4 μmol/L(参考范围 2.9–11.8)。在 5 个月和随后 17 个月大时的随访中,她的生长发育情况良好。检查时未发现明显异常。
患者在 3.5 周、2 个月、3 个月、5 个月和 12 个月时的血浆蛋氨酸浓度分别为 175、185、192、136、75 μmol/L(参考范围 9–43 μmol/L)(见图.1A).血浆氨基酸色谱没有其他异常,包括酪氨酸没有升高。 S-腺苷甲硫氨酸为 90 nmol/L(参考范围 33-95),S-腺苷同型半胱氨酸为 24 nmol/L(参考范围 13-28)。她的谷丙转氨酶间歇性升高(2 月龄和 5 月龄时分别为 68 和 88 单位/L,参考范围分别为 26-61 和 26-51 单位/L),天冬氨酸转氨酶、碱性磷酸酶和总胆红素正常。该患者被发现是 MAT1A 中 c.776C > T (p.Ala259Val) 变体的杂合子(NM_000429.2;见图 1B 和 C)。直接从测序数据中识别外显子水平拷贝数变化的生物信息学算法并未发现基因中的任何缺失或重复。该突变落在酶的二聚化界面中(参见图 1D)。
高蛋氨酸血症基因检测
从患者血液中提取基因组 DNA,并使用 TruSight One 试剂盒 (v1.0) 靶向基因的外显子区域。使用具有 150 bp 配对末端读数的 NextSeq 500 测序系统对这些目标区域进行测序。DNA 序列被映射到已公布的人类基因组构建 UCSC hg19 参考序列,并与之进行比较分析。对已知蛋白质编码 RefSeq 基因的靶向编码外显子和剪接点进行了评估,平均覆盖深度为 10 倍,数据质量阈值为 95%。所有可报告的基因序列突变均通过独立的 Sanger 序列分析得到证实。对甲硫氨酸途径中基因的分子检测发现了 MAT1A 中的一个杂合突变。iCn3D 通过上传包含人类 MAT I 结构信息的 PDB 格式文件实现了 3 维蛋白质结构内突变的可视化。该文件(PDB ID: 2OBV)是从 RCSB 蛋白质数据库下载的 ; 该模型的晶体结构已使用 X 射线衍射确定。
p.Ala259Val 变体是母系遗传的。患者的母亲在 27 岁时蛋氨酸轻度升高 50 μmol/L(正常范围 10-42),而她在 28 岁时的重复血浆氨基酸谱显示蛋氨酸正常,为 33 μmol/L。在这两种情况下,她的转氨酶都是正常的,尽管她小时候确实有肝酶升高的病史,包括持续数月的肝炎样疾病。
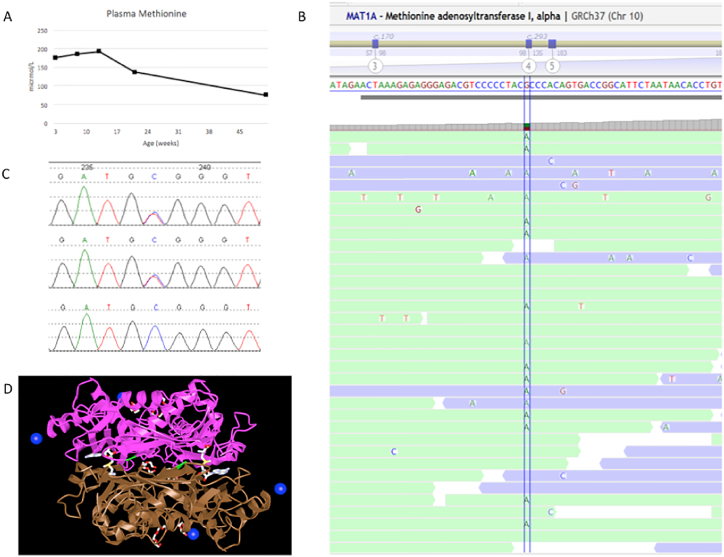
-
先证者血浆甲硫氨酸浓度随时间的变化。B) 与先证者参考序列的下一代测序短读比对。C) 先证者、母亲和父亲的 Sanger 测序色谱图(分别为上图、中图和下图)。D) 人甲硫氨酸腺苷转移酶 III(二聚体),p.Ala259 残基以绿色突出显示,显示其在二聚体界面上的位置。
高蛋氨酸血症基因检测基因解码
p.Ala259Val 突变极其罕见;在 gnomAD 数据库的 123136 个外显子组的 p.Ala259 位置未发现非同义错义变异。此前曾报道三名患者携带MAT1A杂合 p.Ala259Val 变异体,尽管作者特别提到由于未对父母进行检测,因此无法阐明遗传模式。Fernández-Irigoyen 等人与 WT 相比,p.Ala259Val 突变体中的 MAT 活性降低了大约 80%,而 PPPase 活性保持在 WT 水平的 80% 以上。Ala259 位于柔性环中,是 MAT 基因中高度保守的区块,据推测可调节甲硫氨酸进入活性位点并对其定位。环中的其他突变显示出酶活性的类似变化。另一份报告表明,Ala259Val 变体可能会影响二聚化界面。第一位报告有 p.Ala259Val 突变的患者的初始 Met 水平为 204.5 μmol/L,随后的平均水平为 37 μmol/L,其语言、行为和全面智商分别为 67、72 和 61。第二名和第三名患者是具有相同突变但甲硫氨酸升高模式不同的兄弟姐妹(患者 1 和 2 在新生儿筛查中的甲硫氨酸浓度均为 64.3 μmol/L,新颖就诊时分别为 209.8 μmol/L 和 112.8 μmol/L,和平均值分别为 138.8 μmol/L 和 88.75 μmol/L) 。
高蛋氨酸血症基因检测案例患者的甲硫氨酸水平持续升高,但确实显示出随年龄下降的证据。她的母亲也是该突变的杂合子,患有轻度高甲硫氨酸血症。这些发现提供的证据表明, MAT1A中 p.Ala259Val 突变的杂合性是导致常染色体显性遗传性高甲硫氨酸血症的第二个变体。常见的 p.Arg264His 突变已被证明随着年龄的增长的蛋氨酸水平升高不太明显,这种模式已在具有其他杂合突变的患者中显示. 事实上,一项包含 9 名此类患者的病例系列报告称,所有患者均未出现 MATI/III 缺陷症状,所有患者均发育正常,可耐受正常饮食,并且蛋氨酸水平的模式相似,且在随访中呈下降趋势。同样,杂合子状态下的 6 名 p.Arg248Gln 患者和 1 名 p.Gly280Arg 患者的甲硫氨酸水平随时间下降. 预计这两个残基都位于二聚化界面。我们的结果与这种模式一致,因为我们患者的甲硫氨酸似乎随着时间的推移而减少,而她母亲的甲硫氨酸在一个实例中仅略微升高。显性 MATI/III 缺陷中甲硫氨酸水平下降趋势的原因尚不清楚。一种假设是婴儿期的总蛋白质(以及蛋氨酸)摄入量和典型的母乳摄入量高于估计的生长需求,并且当固体食物摄入量增加而牛奶摄入量在 6 至 12 个月之间减少时,这失衡正常化。
患者和她的母亲都有转氨酶升高,在孩子的情况下是轻微的,而在母亲的童年时期是短暂的但很严重。虽然已经在一些患者和MAT1A基因敲除小鼠中描述了电子显微镜下肝细胞形态的轻度异常,并且具有很高的肝细胞癌发病率,但大多数MATI/III 缺陷患者没有肝功能障碍的生化证据。患者的血浆总同型半胱氨酸正常,这是预期的,但在严重的 MATI/III 缺陷中可以看到同型半胱氨酸轻微升高。
这种突变的有害影响有两种潜在机制。Ala259 残基位于蛋白质的二聚化界面,就像之前描述的显性突变一样,预计会通过干扰二聚化 (MAT III) 或四聚化 (MAT I) 以显性负性方式发挥作用的酶。其他作者将残基定位到一个灵活的环上,该环负责将甲硫氨酸定位并进入酶的活性位点. 然而,无法结合甲硫氨酸不太可能解释显性遗传,因为野生型亚基具有足够的活性来利用甲硫氨酸合成 AdoMet。然而,聚合受损确实可以通过干扰野生型酶来解释显性遗传——正如之前的实验所示 ——因为只有聚合酶是活跃的。
总之,高蛋氨酸血症基因检测案例确认MAT1A中的 p.Ala259Val 突变也是常染色体显性高甲硫氨酸血症的原因,并且鉴于其在二聚化界面的位置,可能是通过显性负效应,与先前报道的显性突变一样。
- 【佳学基因检测】代谢性遗传病,基因检测有必要吗?...
- 【佳学基因检测】内分泌和神经内分泌肿瘤基因检测...
- 【佳学基因检测】内分泌瘤临床级基因检测诊断机构...
- 【佳学基因检测】内分泌瘤的基因诊断基因检测...
- 【佳学基因检测】多发性内分泌腺瘤综合征 (MEN)基因检测...
- 【佳学基因检测】遗传性内分泌疾病基因诊断方案...
- 【佳学基因检测】垂体疾病基因检测项目...
- 【佳学基因检测】2024肾上腺疾病基因检测项目...
- 【佳学基因检测】甲状腺疾病基因检测项目大全...
- 【佳学基因检测】内分泌科基因检测项目大全...
- 【佳学基因检测】糖尿病基因检测项目介绍...
- 【佳学基因检测】基因检测如何帮助治疗中链酰基辅酶A脱氢酶缺乏症?...
- 【佳学基因检测】戊二酸血症Ⅰ型遗传性阻断基因检测...
- 【佳学基因检测】PA基因检测及丙酰辅酶A羧化酶缺乏症基因筛查...
- 【佳学基因检测】MMA(甲基丙二酸血症)基因检测实例展示...
- 【佳学基因检测】酪氨酸血症不同亚型的正确诊断案例...
- 【佳学基因检测】江西南昌高酪氨酸血症全外显子基因检测结果判断...
- 【佳学基因检测】瓜氨酸血症基因检测与基因筛查...
- 【佳学基因检测】高甲硫氨酸血症基因检测与基因筛查...
- 【佳学基因检测】CAH基因检测在哪儿做?先天性肾上腺皮质增生症...
- 【佳学基因检测】做无丙型球蛋白血症非布鲁顿型基因解码、基因检测采用什么样品?...
- 【佳学基因检测】做Berardinelli-Seip先天性脂肪营养不良基因解码、基因检测方便吗?...
- 【佳学基因检测】巴一柯综合征Bassen-Kornzweig syndrome基因解码基因检测...
- 【佳学基因检测】安徒生糖原贮积症基因解码、基因检测...
- 【佳学基因检测】甲状腺激素抵抗基因解码、基因检测怎么预约解读?...
- 【佳学基因检测】如何做甲状腺激素抵抗全身性抵抗型基因解码、基因检测?...
- 【佳学基因检测】常染色体显性广泛性甲状腺激素抵抗基因解码、基因检测的报告有人解读吗?...
- 【佳学基因检测】β-半乳糖苷酶-1(GLB1)缺陷基因检测、基因解码...
- 【佳学基因检测】做糖蛋白VI缺乏症基因解码、基因检测需要多少钱?...
- 【佳学基因检测】强迫症基因解码、基因检测的报告看得懂吗?...
- 来了,就说两句!
-
- 最新评论 进入详细评论页>>



