【佳学基因检测】肿瘤耐药性基因检测的药物抗性因素鉴定
治疗对PIK3CA 突变的选择
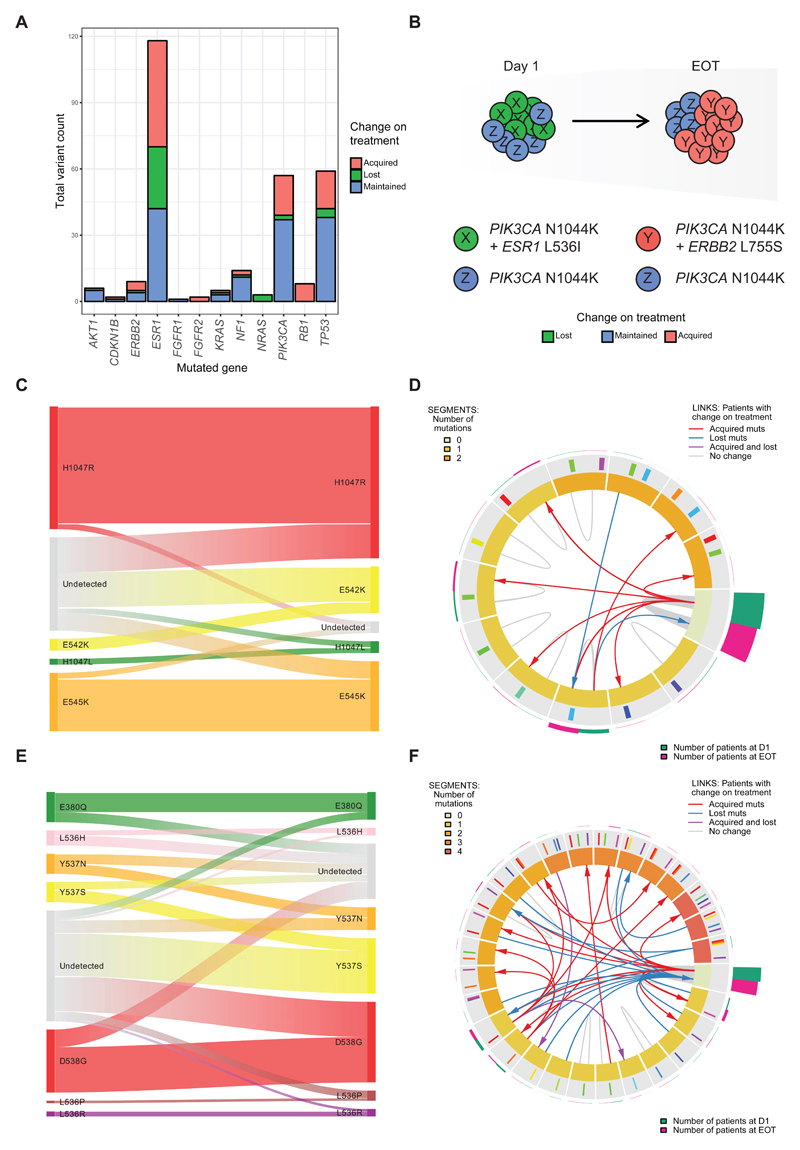
对于 PIK3CA,考虑到两个治疗组,在第 1 天的样本中鉴定出 37 名患者的 39 种变异 (37/195, 19.0%)(图 2A),这与之前的发现一致并表明多克隆性水平较低。 在第 1 天出现的几乎所有 PIK3CA 突变在治疗后都得到了维持 (37/39, 95.7%),这与其中大多数是克隆/主干突变一致(图 2C)。 治疗结束时,检测到来自两个治疗组的 52 名患者的 55 种 PIK3CA 变异 (52/195, 26.7%),与第 1 天相比有所增加(图 2A,p = 0.00069,McNemar 检验)。 总体而言,8.2% 的患者获得了 PIK3CA 突变(16/195,其中一名患者获得了 2 个单独的突变,另一名患者获得了一个额外的 PIK3CA 变体(图 2C)。获得的 PIK3CA 突变已通过 ddPCR 对 H1047R、H1047L、E545K 进行了验证 和 E542K(最常见,占 16/18 的获得性变异),其中 100% (16/16) 验证并显示与测序等位基因分数估计密切一致 (r = 0.97)。考虑到特定的 PIK3CA 突变,有一些 E542K 阳性选择的证据有限(p = 0.041,McNemar 的连续性校正检验,q = 0.41,Bonferroni 校正)。使用数字 PCR 测试第 1 天的样本,少数获得的 PIK3CA 突变在 第 1 天通过数字 PCR(6/18,33.3%,),其中大多数的等位基因频率非常低,低于 ctDNA 测序的检测限,为一些患者提供了先前存在的轻微 PIK3CA 生长的证据 突变亚克隆。 在包含第 1 天数字 PCR 数据的分析中,治疗结束时 PIK3CA 突变患者比例的增加仍然具有统计学意义(p = 0.016,McNemar 检验)。 获得新检测到的 PIK3CA 突变的患者比例在治疗组之间似乎没有差异(图 2C)。 这些数据与最初 PIK3CA 野生型肿瘤的一部分一致,要么积极选择流行率非常低的 PIK3CA 突变亚克隆,要么在用氟维司群治疗时新获得它们。
肿瘤靶向药物治疗对ESR1 Y537S的选择
在治疗开始时 25.1% 的患者中观察到 ESR1 突变(49/195,25.1%,图 2A),在治疗结束时具有 ESR1 突变的患者总数相似(61/195,31.3%) , p = 0.07 McNemar 检验)。 然而,6.7% (13/195) 的患者在基线时检测到 ESR1 突变,但在进展时未检测到 ESR1 突变,同样,在基线时未检测到 ESR1 突变的患者中有 12.8% (25/195) 有新获得的突变 在进展中(补充图 14)。 通过数字 PCR 评估基线时的 ESR1 突变状态显示与测序结果总体一致。
考虑到个体 ESR1 突变,有强有力的证据表明通过两个治疗组的治疗,ESR1 Y537S 的特异性阳性选择(p = 0.0037,McNemar 检验,q = 0.047,Bonferroni 校正图 3A)。 所有获得的 Y537S 突变都在治疗样本结束时通过数字 PCR 重复测试进行了验证(17/17,图 3B)。 考虑到在任一时间点都有 Y537S 调用的样本,有少数获得性 ESR1 Y537S 突变在第 1 天可通过数字 PCR 检测到“获得性”突变(3/17,17.6%,图 3C),提供证据 在一些患者中生长出一个较小的预先存在的 ESR1 Y537S 突变体亚克隆。 在包括第 1 天和治疗结束时的数字 PCR 数据的分析中,治疗结束时 ESR1 Y537S 突变患者比例的增加仍然具有统计学意义(p = 0.0019,McNemar 检验)。 对第 1 天有 Y537S 突变的患者与在治疗结束时获得 Y537S 的患者进行无进展生存期探索性分析显示,尽管数量较少,但仍具有显着性趋势(对数秩 p = 0.011)。 治疗组之间在获得特定 ESR1 突变方面没有明显差异。 总之,这些数据与 ESR1 Y537S 在临床上促进对氟维司群的耐药性一致。
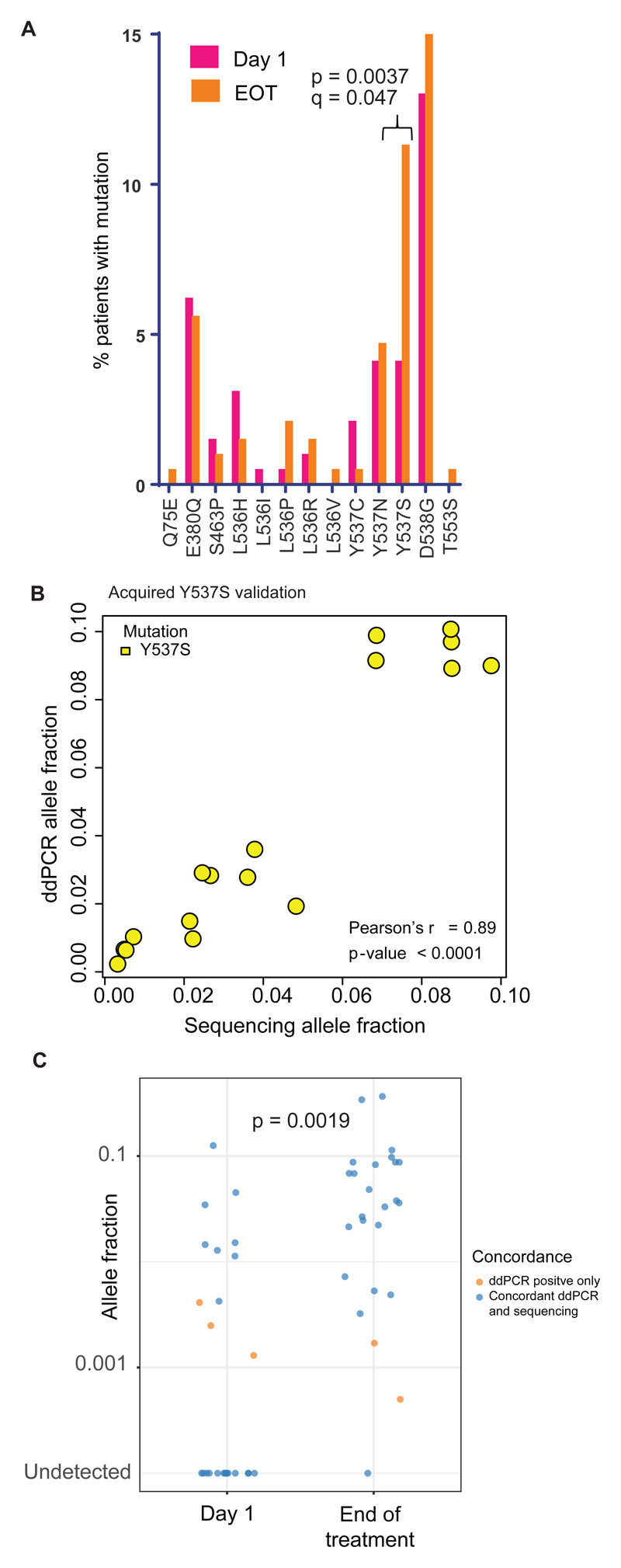
在治疗中获得了更多基因的变异,包括 ERBB2 (1.5%, 3/195)、KRAS (0.5%, 1/195)、FGFR2 (1.0%, 2/195) 的热点激活突变,与 治疗组之间的选择(图 2C)。
治疗过程中突变克隆的演变过程
接下来,肿瘤耐药物基因检测对比了在两个治疗组的不同基因中观察到的克隆变化,分别考虑了单个克隆的过程,以及具有不同亚克隆组合的患者(图 4A,图 4B)。 具有强烈获取新变体(如 RB1 和 PIK3CA)模式的基因在治疗中往往会丢失相对较少的克隆(图 4C,图 4D)。 相比之下,ESR1 突变在治疗过程中表现出显着变化,通过治疗经常丢失和获得不同的突变(图 4E、图 4F),以及高水平的 ESR1 多克隆性 (13)。 与第 1 天相比,患者通常在 EOT 检测到不同的 ESR1 突变组合(图 4F,补充图 14),并且在任何时间点检测到的 ESR1 变异只有 35.6% 在这两个时间点都被检测到,因此在治疗中得以维持 (42/118) . 在 ESR1 突变中观察到的这种多克隆流模式支持了个体 ESR1 突变标记个体肿瘤亚克隆的观察结果(图 1),证明了治疗提供的频繁克隆选择压力。
通过治疗,拷贝数概况主要保持一致
肿瘤耐药物基因检测接下来评估了血浆中的拷贝数变异。 外显子组拷贝数概况 (n = 14) 在第 1 天和 EOT 之间在 palbociclib 加氟维司群之间基本一致(补充图 18,补充图 19),与在单核苷酸变体中观察到的克隆进化形成对比(图 1)。 包括 RB1 基因座在内的 13q 丢失在第 1 天时有 6/14 (42.9%) 患者丢失,在治疗结束时有 5/16 (31%) 患者丢失,其中大部分在第 1 天出现 (4 /5, 80%, 补充图 20)。 随着 bin 大小的逐渐减少,这些发现没有变化,以研究 RB1 中的大基因内缺失。
为了将拷贝数概况评估扩展到外显子组测序之外,肿瘤耐药物基因检测使用靶向测序组对来自两个治疗组的第 1 天和治疗结束样本的一组更大的匹配对进行了评估,该组评估了 RB1、PTEN 和 CDKN2A 的丢失、肿瘤纯度和评估 乳腺癌中常见的 12 个基因的拷贝数(材料和方法)。 总共对 324 个样本进行测序以评估拷贝数,中位覆盖率为 1329X,包括 163 个第 1 天样本和 154 个配对的 EOT 样本。
由于评估血浆 DNA 中的拷贝数,特别是拷贝数丢失,高度依赖于具有足够的肿瘤纯度,因此仅使用具有至少 20% 肿瘤纯度的样本子集来评估丢失。 在第 1 天的样品中,37 个估计纯度≥20%,其中 51 个 EOT 样品纯度≥20%,17 名患者进行配对分析。 疾病部位数量与肿瘤含量 >10% 之间存在关联(p = 0.039,Cochran-Armitage 检验)。 第 1 天样本中的 6/37 名患者 (16.2%) 和治疗结束样本中的 14/51 名患者 (27.4%) 发现 RB1 丢失(p = 0.30,Fisher 正确检验)。 在这些损失中,肿瘤耐药物基因检测的方法也可以识别亚基因缺失。 在 EOT 样本中,肿瘤耐药物基因检测发现了 3.8% (2/51) 的亚基因缺失,其中一个也有配对的第 1 天样本缺失,表明这些缺失预先存在,并且不是在治疗期间获得的。 在配对 >20% 纯度的 17 个样本中,没有证据表明选择 RB1 治疗损失(补充图 24,p = 0.25,McNemar 检验),尽管该分析受到样本量的限制。 对于 PTEN 和 CDKN2A 也观察到一致的拷贝数虽然处理。
第 1 天和治疗结束时的拷贝数增加数据在那些肿瘤纯度 >10% 的样本中进行评估,并且与原发性乳腺癌中观察到的光谱基本一致,在 CCND1、MYC 和 FGFR1 中鉴定出扩增,没有选择的证据或 配对纯度 >10% 的 43 个样本在处理结束时损失(补充图 25)。 两名患者在治疗结束时获得了 FGFR2 扩增(补充图 25)。 治疗结束时没有获得性 CCNE1 或 CCNE2 扩增的患者。
遗传变异的选择发生在 palbociclib 加氟维司群的后期
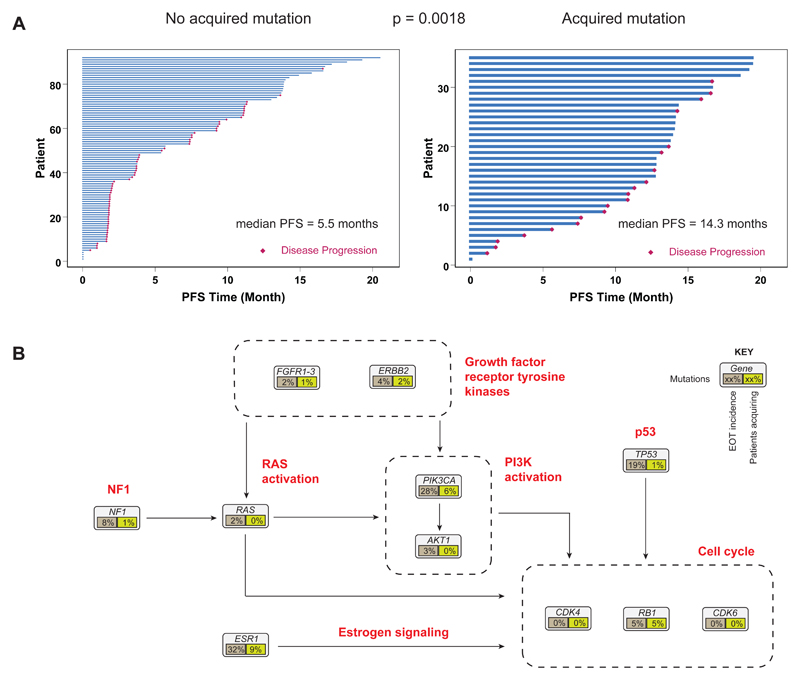
为了研究与治疗突变选择相关的临床因素,肿瘤耐药物基因检测探讨了治疗时间 (PFS) 与接受哌柏西利加氟维司群(图 5)和安慰剂加氟维司群的患者在 EOT 时获得新突变之间的关系。 与未获得突变的患者相比,治疗结束时任何获得性突变的存在与更长的 PFS 相关(图 5A,中位数 14.3 个月获得性与 5.5 个月未获得性,对数秩 p = 0.0018,),表明新 接受更长时间治疗的患者更有可能发生突变。 这种趋势也分别出现在获得性 ESR1 突变和 PIK3CA 突变中,这两个基因的突变占获得性突变的大部分(图 5B)。 获得性 RB1 突变太少,无法有意义地评估与 PFS 的关系。 对已获得突变的患者的基线临床病理特征进行的评估揭示了与骨转移的存在相关的一些证据(p = 0.013,q = 0.15)。
基因检测耐药性的分析结果
CDK4/6 抑制剂联合内分泌治疗现在代表了晚期激素受体阳性乳腺癌的标准治疗,但对这些治疗的耐药机制知之甚少。 在这里,肿瘤耐药物基因检测研究了这些乳腺癌中对哌柏西利加氟维司群耐药的遗传机制的演变,并表明克隆进化在治疗反应中很常见。 确定了驱动基因的三个主要变化。 RB1 的获得性突变相对较少发生,并且通常是亚克隆的,在 palbociclib 加氟维司群后 5% 的患者血浆中检测到(图 2A-C)。 在接受哌柏西利加氟维司群治疗的患者中经常检测到生长因子受体和信号转导通路的获得性驱动突变,总共发生在 39/127 (30.7%) 的患者中(图 2C,图 5D),其中 6% 的患者占主导地位 获得 PIK3CA 突变,与第 1 天相比,在治疗结束时至少有 1 个 ESR1 突变的患者增加了 9%(图 5D)。 观察到 ESR1 突变的演变,选择 ESR1 Y537S 作为最有可能促进组合中对氟维司群抗性的变体(图 3A,图 4E)。 相反,因为在肿瘤耐药物基因检测小组中检测到的突变的获得或选择主要见于治疗持续时间较长的患者。 这表明,患有本质上对治疗有耐药性的肿瘤患者获得突变的频率较低,这可能是由于缺乏治疗的选择性压力,并且其他耐药机制可能在早期进展中占主导地位。
临床前工作已将 RB1 突变 (9,11) 确定为 CDK4/6 抑制的耐药机制,这与 CDK4/6 抑制剂的功效需要功能性 Rb 的文献一致 (18)。 在这些潜在的耐药机制中,只有 RB1 中的突变已在临床上得到鉴定,尽管它们在接受治疗的人群中的流行率尚不清楚 (11)。 Condorelli 及其同事最近报道了 3 名在接受 CDK4/6 抑制治疗后出现 RB1 突变的患者,其中 2 名在之前的内分泌治疗中接受了 palbociclib 和 fulvestrant,而其他 ribociclib 和来曲唑作为晚期疾病的一线治疗 (11)。 凭借分析无偏倚注册研究的优势,肿瘤耐药物基因检测的研究证实了 RB1 畸变对 palbociclib 加氟维司群的明显阳性选择,但证明它们仅在少数患者中明显(图 2A)。 在这些患者中,肿瘤耐药物基因检测发现了多克隆 RB1 畸变,提示在选择性压力下表型收敛,例如内分泌治疗响应的 ESR1 突变 (13,19)。 有趣的是,RB1 突变仅在 ESR1 突变的野生型肿瘤中被选择(图 2D)。 尽管肿瘤耐药物基因检测无法排除偶然发现,但这确实可能表明,当 ESR1 突变不损害氟维司群疗效时,可以选择 RB1 突变,表明产生耐药性的不同途径。 肿瘤耐药物基因检测对相对不常见的 RB1 突变的发现很重要,这表明后续的基于内分泌的治疗线有可能对进展有效,这与目前可用的进展后临床数据一致 (15)。
除了 RB1 突变外,氟维司群和 palbociclib 组与氟维司群和安慰剂组之间的获得性突变谱没有明显差异(图 2C)。 这一随机试验背景下的观察结果表明,对氟维司群的耐药性是对联合治疗耐药的主要遗传驱动因素,可能是肿瘤能够适应 CDK4/6 抑制,而不会抑制 ER 信号。 ESR1 突变是对芳香化酶抑制剂产生耐药性的重要机制,配体结合域发生突变,尤其是螺旋 12,从而产生组成型活性蛋白 (20,21)。 然而,在基线检测到多个耐药亚克隆并不能预测 palbociclib 在 PALOMA-3 中的活性 (13)。 肿瘤耐药物基因检测的数据表明,第 1 天出现的 ESR1 突变中有很大一部分在哌柏西利联合氟维司群中丢失,至少部分反映了治疗的高水平克隆进化,ESR1 突变丢失反映了敏感亚克隆的丢失(图 1C,1G) ),在随后的氟维司群治疗期间,两个治疗组中的其他人以相同的速度和模式出现(图 2C)。 肿瘤耐药物基因检测发现在治疗结束时 Y537S 呈阳性选择的证据(图 3A、图 3D、图 4E),这是在临床前研究中确定为对氟维司群最耐药的配体结合域突变 (22)。 这表明对 palbociclib 加氟维司群组合的耐药机制的独立、平行演变。
在生长因子受体和信号转导通路中观察到进一步获得性驱动突变(图 5D)。 PIK3CA 突变是 ER 阳性原发性乳腺癌的重要基础变异 (12),并且在大多数转移性乳腺癌中保持克隆优势 (23)。 肿瘤耐药物基因检测现在确定,6% 在第 1 天未检测到 PIK3CA 突变的患者在使用 palbociclib 加氟维司群治疗结束时获得或积极选择了新出现的明显 PIK3CA 突变(图 2C、4A、图 4C、图 4D),特别是 本研究中的 E542K(补充图 11)。 出现的 PIK3CA 突变的流行率在治疗组之间似乎没有差异(补充图 13),支持这些主要影响氟维司群耐药性的假设(24)。 通过外显子组测序,肿瘤耐药物基因检测确定了 ABOPEC 在驱动克隆多样性和对 palbociclib 加氟维司群的耐药性方面的作用(图 1D、1H)。 肿瘤耐药物基因检测注意到 E542K 是一个潜在的 APOBEC 位点,E542K 的优势可能提供进一步的证据支持 APOBEC 诱变促进晚期 ER 阳性乳腺癌的遗传多样性 (25,26)。
肿瘤耐药物基因检测的研究还有与现有关于 CDK4/6 抑制剂耐药机制的临床前文献相关的潜在重要发现。 先前的临床前工作分别在 palbociclib 和 abemaciclib 耐药模型中确定了 CCNE1(9) 或 CDK6(10) 的获得性扩增。 肿瘤耐药物基因检测没有发现获得性 CCNE1、CDK4 或 CDK6 扩增与临床相关的证据,尽管肿瘤耐药物基因检测确实注意到,由于肿瘤纯度低的挑战,循环肿瘤 DNA 分析在分析拷贝数方面受到限制。 肿瘤耐药物基因检测通过采用一种新的靶向测序方法来部分解决这一限制,以允许同时评估纯度和拷贝数,将拷贝数分析限制为对肿瘤纯度至少为 10% 的肿瘤进行增益分析,对肿瘤纯度至少为 20% 的肿瘤进行损失分析 (补充图 21-25)。 肿瘤耐药物基因检测的血浆肿瘤纯度观察结果与 Adalsteinsson 等人 (27) 报道的大乳腺癌组中肿瘤含量 >10% 的三分之一患者相当,肿瘤耐药物基因检测研究中观察到的纯度比例略高(第 1 天的 42% 样本,68/163,和 53% 的治疗结束样本,82/154)可能是由于所有样本都在研究中规定的严格协议下处理。 然而,肿瘤耐药物基因检测强调 ctDNA 分析不太可能检测到许多亚克隆扩增或丢失。 此外,肿瘤耐药物基因检测没有发现 CDK4 或 CDK6 中守门人突变的证据,并且可以有效地将其排除在常见的耐药机制之外(图 2A)。
这一个肿瘤耐药物基因检测的研究还有许多进一步优化的地方。由于肿瘤含量的变化,很难在循环肿瘤 DNA 的纵向时间点之间进行比较 - 无法识别突变可能是由于血浆中不存在肿瘤 DNA,或者存在于测序噪声中的低水平。 肿瘤耐药物基因检测通过进行二次分析来缓解这种担忧——使用数字 PCR 分析基线血浆以发现新出现的突变,并对第 1 天肿瘤含量已知的患者进行子集分析。 纯度问题对于评估基因组丢失特别具有挑战性,对于需要在多个时间点对肿瘤内容置信度的比较分析而言,纯度问题更加复杂。 这可能会限制对 RB1 丢失的调查,肿瘤耐药物基因检测建议需要基于组织的分析来对进展中的拷贝数进行明确分析。 尽管肿瘤耐药物基因检测通过配对外显子组测序分析了 14 名患者,但为了发现和设计肿瘤耐药物基因检测的目标组,肿瘤耐药物基因检测无法解决是否存在未被肿瘤耐药物基因检测的目标组询问的罕见获得性事件。 此外,肿瘤耐药物基因检测从治疗时间超过 2 年的患者中询问了相对较少的治疗结束血浆样本,因此肿瘤耐药物基因检测无法解决非常晚期的进展是否可能具有不同的获得性突变模式。 最后,肿瘤耐药物基因检测在本手稿中使用“获得性”一词来反映在 EOT 时可检测到的突变,但在第 1 天检测不到。评估这些突变是否可能在未成年人治疗之前就已经存在于肿瘤中是非常具有挑战性的 和检测不到的亚克隆。 使用非常高灵敏度的数字 PCR 对 Y537S 进行详尽调查,肿瘤耐药物基因检测确实在非常低的水平上分别在第 1 天和治疗结束时检测到一些“获得的”和“丢失的”突变,但表明这些在两个时间点之间是平衡的,并且确实 不会显着影响比较结果(图 3D)。
肿瘤耐药物基因检测的工作展示了通过配对 ctDNA 分析审问大型注册试验的价值,展示了乳腺癌驱动因素中正在进行的克隆进化如何破坏 palbociclib 加氟维司群疗法,强调 APOBEC 诱变在促进克隆进化方面的潜在作用,并确定了可以改善的合理治疗策略 CDK4/6 抑制的功效。
- 【佳学基因检测】非小细胞肺癌抗药后基因检测所带来的新方案...
- 【佳学基因靶向药物基因检测】 BRAF V600E 突变的非小细胞肺癌腹膜癌患者对加曲美替尼的有希望的反应...
- 【佳学基因靶向药物基因检测】与突变无关的 RNA 干扰工程替代品可挽救与 Tmc1 相关的听力损失...
- 【佳学基因检测】基因病基因缺陷疾病的基因治疗...
- 【佳学基因检测】达拉非尼疗法和BRAF基因型基因检测...
- 【佳学基因检测】右侧单冠状缝早闭症基因筛查测试...
- 【佳学基因检测】如何使用威诺利克(Venclexta)治疗白血病患者?...
- 【佳学基因检测】食道癌高水平治疗使用的曲妥珠单抗(Herceptin)病理检测指标...
- 【佳学基因检测】白血病降低痛苦用药使用维甲酸(Vesanoid)分子诊断结果...
- 【佳学基因检测】乳腺癌曲妥珠单抗(Kadcyla)靶向药物基因检测...
- 【佳学基因检测】得了胃癌如何采用尼沃鲁单抗(Opdivo)进行靶向治疗?...
- 【佳学基因检测】头颈癌增加治疗效果时选用的帕姆单抗(Keytruda)基因检测依据...
- 【佳学基因检测】使用帕姆单抗(Keytruda治疗子宫内膜癌之前要做什么基因检测?...
- 【佳学基因检测】使用阿韦珠单抗(Bavencio)治疗内分泌和神经内分泌肿瘤,会减少病人痛苦吗?...
- 【佳学基因检测】肺癌药物处方治疗曲美替尼(Mekinist)基因检测信息...
- 【佳学基因检测】食道癌尼沃鲁单抗(Opdivo)正确医学基因检测...
- 【佳学基因检测】肺癌如何使用特普替尼(Tepmetko)会产生靶向药效果...
- 【佳学基因检测】胃肠道间质瘤舒尼替尼(Sutent)靶向治疗基因检测...
- 【佳学基因检测】肝癌和胆管癌选择非替尼(Inrebic)基因检测指标...
- 【佳学基因检测】乳腺癌正确治疗使用的玛格曲希单抗(Margenza)的前提条件...
- 【佳学基因检测】肺癌什么时候选择甲磺酸奥希替尼(Tagrisso)达到正确医学水平?...
- 【佳学基因检测】使用普拉替尼(Gavreto)治疗肺癌,肿瘤会不会减小?...
- 【佳学基因检测】身体任何部位的实体瘤使用靶向药物治疗曲美替尼(Mekinist)所需NGS结果...
- 【佳学基因检测】什么样的结直肠癌患者需要使用齐夫-阿飞单抗(Zaltrap)?...
- 【佳学基因检测】使用沃利替尼(Zolinza)治疗淋巴瘤之前要做什么基因检测?...
- 【佳学基因检测】淋巴瘤患者如何知道是否需要使用赞布鲁汀(Brukinsa)?...
- 【佳学基因检测】膀胱癌降低痛苦用药使用沙西他胺戈维替坎(Trodelvy)分子诊断结果...
- 【佳学基因检测】乳腺癌增加治疗效果时选用的沙西他胺戈维替坎(Trodelvy)基因检测依据...
- 【佳学基因检测】淋巴瘤增加治疗效果时选用的塞林昔(Xpovio)基因测试要求依据...
- 【佳学基因检测】如何采用基因检测增加塞林昔(Xpovio)对多发性骨髓瘤的治疗效果?...
- 来了,就说两句!
-
- 最新评论 进入详细评论页>>



