【佳学基因检测】精子运动能力基因解码如何指导基因检测?
遗传病、罕见病基因检测导读:
基因解码是一种新型基因信息分析方法,它是基因检测位点选择和基因解读的最终理论和实践依据。本文介绍了基因解码是如何解析精子运动力产生的刺激信号,精子细胞的钙内流这一过程的。它从一个方面揭示了男子不育症的基因解码和基因检测的关系。
Catsper调控与[Ca2+]信号转导
基因解码表明两种钙离子通道调节男性生育能力,这是男性不孕症基因检测中需要考虑到,才能检测更全,不漏检。(1)调节储存控制的钙离子的进入的Orail通道,和(2)基因解码研究最广泛的钙离子通道Catsper通道。精子特异性Catsper通道控制细胞内Ca2+浓度([Ca2+]i)。采用小鼠所做的实验表明,Catsper1和Catsper2缺失小鼠的鞭毛弯曲幅度较正常小鼠的精子低。在Catsper1和Catsper2敲除小鼠中,增加精子内[Ca2+]i鞭毛弯曲和振幅可以异常低水平增加到正常的预激活水平。在大多数哺乳动物中,精子的活化依赖于钙从细胞外空间或细胞内的细胞器进入精子细胞质。因此,Catsper通道至少控制着精子的游动行为。
pH调节Catsper离子通道
Catsper通道是一个pH敏感的离子通道,高pH水平是精子过度激活的必要条件。因此,调节精子酸碱特性的因素也会影响精子Catsper通道开放的程度。基因解码研究发现,小鼠精子在人工碱化的细胞内环境中会导致钙离子增加。另外,孕酮、前列腺素和ZP3可通过增加[Ca2+]i诱导精子获能和顶体反应。然而,后来的基因解码表明,这些生物活性分子在精子顶体反应和获能过程中引发的精子内Ca2+的增加受精子内pH微环境的影响。然而,目前还不有效清楚碱化对精子Catsper通道的影响。H+是酸碱微环境的主要调节者,Na+/H+交换蛋白(NHEs)和电压门控H+通道1(HV1)是H+相关通道。NHEs将Na+导入质膜并将H+输出精子,而HV1去除细胞内H+以维持精子中pH值(pHi)的平衡。此外,Ca2+腺苷三磷酸酶(Ca2+ATPase)泵从精子中去除细胞内的Ca2+,同时允许H+通过质膜进入。相应地,Catsper通道将Ca2+导入精子以维持Ca2+稳态。除此之外,Na,K-ATPase(NKA)和Na+/Ca2+交换蛋白(NCX)也会影响人类精子中的离子环境。事实上,高水平的细胞内Ca2+和低水平的细胞内H+有助于精子的过度活跃。不同离子通道与Catsper通道的关系如图所示。
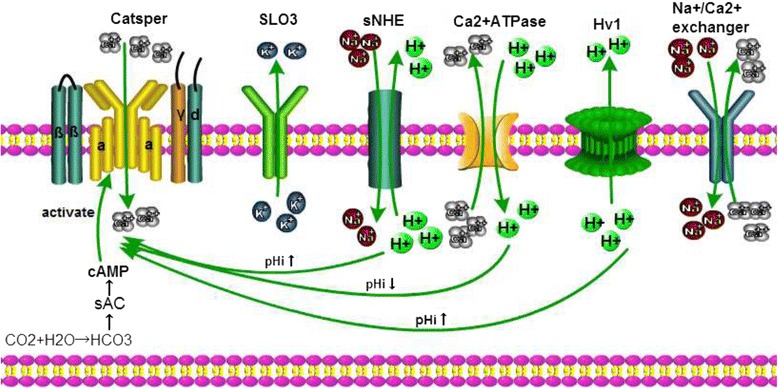
H+通道
(1) Na+/H+交换通道
Na+/H+交换蛋白(NHEs)负责Na+和H+的交换。它们也是广泛分布于所有原核生物和真核生物中的整合膜蛋白。NHEs包括由SLC9基因家族编码,有13种NHE亚型,但在精子细胞中仅存在NHE1、NHE5和sNHE三种亚型。其中,sNHE是决定生育能力的关键亚型。也就是说,敲除NHE1和NHE5基因不会导致小鼠不孕,但是sNHE缺失或sNHE功能损伤会导致小鼠精子的活动性和能动性丧失而变得不育。通过提供氯化铵来提高pH值水平可以恢复部分生育能力,但是cAMP类似物可以有效恢复生育能力。此外,sNHE蛋白质C末端具有一个核苷酸结合域。因此,sNHE亚型是生育能力所必需的,环核苷酸可能通过激活sNHE来控制Catsper通道和增加pHi。此外,sNHE有助于维持碱性环境,使Catsper通道进一步调节超极化。除了维持精子的pH值动态平衡外,sNHE还调节精子成熟度,促进上皮细胞对盐和水的吸收。干扰sNHE的功能的突变会导致不孕。因此,靶向sNHE可能是开发新的避孕方法的一个有希望的策略。与Catsper通道一样,sNHE位于精子鞭毛的主要部分,这表明Catsper通道可以感知pHi变化带来的sNHE的改变来调节Catsper功能。
(2) Hv1通道
Hv1是另一个电压门控H+通道。与sNHE和Catsper通道类似,Hv1也位于精子鞭毛的主要部分。就其功能而言,Hv1和sNHE的主要区别在于Hv1仅通过从精子中去除细胞内H+来维持细胞内碱化。膜片钳技术在人类精子获能的生理过程中检测到Hv1通道的负电流,这表明Hv1与精子获能有关。有趣的是,这种负电流没有从老鼠的Hv1通道检测到。也就是说,小鼠精子中没有H+通过Hv1排出。我们怀疑sNHE独立完成小鼠精子的酸碱调节。如果是这样的话,敲除小鼠Hv1基因应该不会影响生育能力,但是没有足够的证据证明这一假设,Hv1在小鼠体内的实际作用机制有待进一步研究。
K+通道
sNHE诱导Na+和H+交换导致pHi升高,sNHE和Catsper均为电压依赖通道。此外,细胞膜的超极化与电容有关。K+有助于维持精子膜电位的平衡。实现这一平衡的K+通道是SLO3和Kir通道。其中SLO3通道是精子特异性和pH敏感的K+通道。与Catsper通道类似,SLO3还与精子的多动和运动密切相关。影响Catsper通道的SLO3通道的另一个关键功能是维持精囊内鞭毛的电流平衡。精子静止跨膜电位范围是−35至-45mv,但当K+从细胞中移出并启动超极化时,精子跨膜电位降低到-70mv。随后触发一系列生理过程,包括Na+/H+交换活化、精子获能和精子结合ZP3。
钙通道
精子中存在三种钙离子相关通道(Catsper通道、Ca2+ATPase和Na+/Ca2+交换通道)。Catsper通道负责Ca2+进入精子孔,促进精子运动。Ca2+ATPase是一种Ca2+/H+交换蛋白,它去除细胞内的Ca2+,并允许H+进入精子细胞,与Catsper通道不同。Ca2+ATPase对Catsper通道和精子受精有负性调节作用。此外,Na+/Ca2+交换蛋白从精子中输出一个Ca2+离子,并允许三个Na+离子进入,这对于维持细胞内环境的Ca2+平衡至关重要。
碳酸氢盐(HCO3−) 转运蛋白
HCO3− 是精子获能必不可少的,这通常被认为是精子活力早期激活的开始。例如,经人工碱化处理的小鼠精子产生细胞内Ca2+增加。添加HCO3− 显示出同样的效果,同时也增加了精子的跳动频率。这些数据表明HCO3的运输− 通过增加精子pHi影响精子活力。此外,HCO3− 激活非典型可溶性腺苷酸环化酶(sAC),增加cAMP水平,以及cAMP介导的途径,增加鞭毛搏动频率(cAMP介导的途径可以激活Catsper通道)。因此,HCO3− 激活Catsper通道是促进Ca2+的增加,这可能是通过增强cAMP的生成来实现的。此外,CFTR是一个与人类精子获能有关的Cl− 和HCO3−跨膜转运蛋白。CFTR通过调节cAMP信号通路来控制许多转运蛋白。值得注意的是,CFTR转运体的抑制会影响HCO3−-诱导cAMP增加,导致PKA活性降低。此外,降低CFTR活性也会通过调节cAMP下游信号级联导致酪氨酸磷酸化降低和运动过度减少。HCO3− 转运蛋白由精子中的SLC4、SLC26和CFTR基因家族编码,这些转运蛋白构成了哺乳动物细胞中与pH调节相关的跨膜蛋白的主要家族。Western印迹、免疫细胞化学、qRT-PCR和免疫沉淀结果表明,SLC26A3、SLC26A6和SLC9A3R1在小鼠精子鞭毛的中段被检测到。在获能和超极化过程中,这些蛋白质相互作用以增加pH值。另一方面,HCO3− CFTR转运蛋白位于鞭毛中部,但不与Catsper通道共定位。基因解码推测HCO3− 通道通过影响顶体反应间接影响Catsper通道的开放或关闭状态。
HCO3− 精子活力的早期激活信号。HCO3的产生是由碳酸酐酶(CAs)催化完成的。因此,CAs在受精过程中对精子至关重要。佳学基因,一个致力于通过研究体体内的生命过程从而解读基因作用的专业机构研究表明,CAs有三种作用:(1)催化生成HCO3−, (2) 调节精子的pHi,以及(3)调节精子顶体反应。CAII和CAIV是具有催化活性的核心亚单位,敲除它们中的任何一个都会降低精子活力、精子运动速度和精子搏动频率。CAII位于精子的主要部分,Catsper通道也位于这里。另一方面,CAIV位于整个精子尾部的质膜内。对人类获能精子和小鼠获能精子施用碳酸酐酶抑制剂,如乙氧唑胺,结果表明,人类获能精子的顶体反应增加,但小鼠获能精子的顶体反应没有增加。这些结果表明CAs在人和小鼠精子中具有不同的功能。然而,关于CAs如何参与精子受精的研究却很少。CAs在运动过程中直接参与维持离子的平衡。例如,当向精子注入二氧化碳时,鞭毛搏动频率增加,并且这种效应被乙氧基唑胺抑制。与野生型和CAIV−/− 小鼠相比较,CAIV的生理作用是为精子提供HCO3−,以刺激产生可溶性腺苷酸环化酶。总之,碳酸酐酶可以影响碱性环境和HCO3− 精子中的浓度。CAs可能通过调节Catsper通道影响精子顶体反应。
调节Catsper通道的体内生理信号
细胞外Ca2+如何进入精子尚不清楚,但与受精相关的一些生理刺激通过Catsper通道诱导Ca2+进入增加[Ca2+]i。这些刺激包括孕酮、环核苷酸(如cAMP、cGMP)、ZP糖蛋白、BSA和碱性去极化。这些元素共同诱导一系列的生理事件,包括获能、顶体反应和受精。
环核苷酸诱导钙离子进入
cAMP/PKA信号通路在哺乳动物中被用来调节基因转录。事实上,精子获能是一个cAMP依赖的过程,它上调Ca2+浓度和酪氨酸磷酸化水平。环腺苷酸由多种腺苷酸环化酶(ACs)合成,通常分为两类:跨膜腺苷酸环化酶(tmACs)和sAC。重要的是,sAC介导的cAMP/PKA信号级联对精子获能至关重要,因为sAC突变或sAC缺失的小鼠可以产生精子,但精子没有向前运动,导致男性不育。给予sAC突变或sAC缺失小鼠cAMP类似物可以有效恢复先前丧失的运动能力,但精子在体外受精时仍然没有表现出过度活跃。此外,sAC不仅参与cAMP的产生,还参与受精过程中的其他机制。具体来说,sAC在受精过程中有三种作用。首先,sAC是一种HCO3− 传感器。HCO3-刺激后sAC结构域发生重排−, sAC通过提高精子中cAMP水平而被激活。sAC的第二个功能是充当pH传感器。先前的研究表明,sAC调控着狗鱼精子的酸碱平衡,其基因起到了监测CO2和HCO3-浓度的作用,保持适宜的pH值微环境。sAC的最后一个功能是作为钙离子传感器或钙调素。作为HCO3-的替代品−, Ca2+能刺激sAC与ATP结合产生cAMP。环腺苷酸是一种第二信使分子,参与许多生理过程,包括精子向卵子的趋化和获能。一项研究表明,细胞外cAMP/cGMP增加了Ca2+浓度。当向精母细胞提供8-Br-cAMP/cGMP或提供碱性去极化以激活精母细胞时,细胞内Ca2+浓度的Catsper依赖性增加从主节开始,并通过中段到达头部。这个过程发生在几秒钟之内。此外,与野生型精子相比,Catsper1突变精子的细胞内ATP水平较低。此外,海洋无脊椎动物中的cGMP信号功能是将趋化剂转化为鞭毛中[Ca2+]i的增加,从而增加趋化过程中的游泳行为。所有这些发现都表明,环核苷酸诱导精子主体部分的钙离子内流,但没有明确的证据表明,这一环核苷酸介导的过程直接参与诱导[Ca2+]i增加。然而,通过使用8-Br-cNMP处理的细胞,一项研究已经证明,环核苷酸调节孕酮最终增加[Ca2+]i。
基因解码还发现,Catsper通道在ZP诱导的Ca2+进入小鼠精子过程中起着关键作用。使用膜片钳技术,在Catsper1空白小鼠精子中检测不到ZP刺激2分钟后的Ca2+电流,表明Catsper通道是ZP诱导[Ca2+]i增加所必需的,并表明ZP诱导的[Ca2+]i增加从精子尾部开始并向精子头部传播。
ZP诱导Ca2+进入
女性生殖道中的卵母细胞外面有一层叫做ZP的保护性外膜。卵母细胞周围的ZP蛋白在受精过程中非常重要,因为精子只有通过ZP蛋白完成顶体反应才能参与受精。事实上,ZP糖蛋白在小鼠体内由三个亚单位组成:ZP1、ZP2和ZP3。而人精子中存在4个亚基ZP1、ZP2、ZP3和ZP4。精子顶体与卵子ZP的接触是如何导致[Ca2+]i增加的?事实上,精子接触卵子时,精子需要通过ZP的能力(这是通过[Ca2+]i增加实现的)。顶体通过胞吐过程分泌囊泡,最终完成顶体反应。早期的研究报道,在体内实验中向获能精子中添加ZP可增加[Ca2+]i,而添加ZP抑制剂(即tyrphostin A48、百日咳毒素和3-quinuclidinyl benzilate)可抑制ZP诱导的顶体反应并降低小鼠精子中Ca2+的细胞内浓度。这些效应可能与G蛋白的信号转导有关。β1,4-半乳糖基转移酶-I(GalT-I)是ZP3的一种受体,它形成了一种异三聚体G蛋白复合物。GalT-I缺失小鼠精子仍能与ZP3结合,但精子失去了完成顶体反应和跨越ZP的能力。与能完成顶体反应的小鼠精子相比,人类精子不仅需要ZP3结合,而且需要ZP4结合。此外,哺乳动物瞬时受体电位(Trp)蛋白是Ca2+通道受体,对调节Ca2+进入小鼠精子至关重要。Trp被ZP3激活的G蛋白和磷脂酶C激活。ZP诱导的Ca2+进入精子有助于产生顶体反应和改变精子活力,这两种功能都是通过附睾表达的β-防御素蛋白来实现的。
孕酮诱导钙离子升高
黄体酮围绕在雌性生殖道的卵子周围,由卵丘细胞释放。孕酮通过Catsper通道诱导Ca2+进入精子,从而促进顶体反应。已经深入研究过孕酮是如何调节钙离子浓度的。当人类精子暴露于孕酮浓度梯度以模拟精子接近卵子时,发现[Ca2+]i增加。直接向培养基中添加钙离子未能诱导这一过程,但添加肌浆/内质抑制剂可阻断[Ca2+]i的增加。这些数据表明,孕酮诱导的Ca2+内流是通过释放精子中储存的Ca2+介导的,因此可能会影响精子的行为。Catsper通道增加[Ca2+]i的机制之一是通过释放储存的Ca2+,我们推测孕酮诱导的Ca2+内流可能由Catsper通道介导。一项研究记录了人类附睾和睾丸精子的Catsper电流,结果表明,Catsper通道在精子发育早期对孕酮敏感,这种敏感性在精子最终射精时逐渐增加到峰值。蛋白激酶和磷酸酶参与孕酮诱导的Ca2+增加:添加PKA抑制剂或蛋白酪氨酸磷酸酶抑制剂可减少孕酮诱导的Ca2+内流和孕酮诱导的顶体收缩。2010年,两个研究小组提出,作为鱼精子中的孕酮受体,Catsper通道起着增加细胞内钙离子浓度的作用。此外,2011年的一项研究表明,孕酮是一种类固醇激素,通过一个明确的孕酮核受体调节Catsper基因的表达,从而激活人类精子中的Catsper通道。此外,Catsper蛋白是一种非基因组孕酮受体,碱性pH和孕酮刺激Ca2+内流,但被Catsper抑制剂NNC55–0396和mibefradil阻断。
其他通过Catsper通道诱导Ca2+进入的刺激物质
另外一个促进钙离子通过Catsper通道进入精子的刺激物是BSA。BSA在几种哺乳动物精子获能中起作用。BSA也能诱导细胞内Ca2+浓度增加,但在Catsper1基因敲除的精子中没有这种作用。加入EGFP-Catsper1融合蛋白,恢复BSA诱导的细胞内Ca2+浓度增加。用牛血清白蛋白观察到的钙浓度变化在几秒钟内从精子主体传播到中间部,最终传播到头部。
- 【佳学基因检测】北京Y染色体微缺失基因检测...
- 【佳学基因检测】长期不育男人原因查找基因检测...
- 【佳学基因检测】特发性低促性腺激素性性腺功能减退症基因检测机构评比结果...
- 【佳学基因检测】男性性发育异常基因检测的复杂性变简单了...
- 【佳学基因检测】圆头精子症生育能力恢复基因检测机构选择...
- 【佳学基因检测】大头多尾精子症基因检测单项包括什么内容?...
- 【佳学基因检测】精子头部畸形医生要求基因检测包括什么?...
- 【佳学基因检测】精子尾部畸形发病原因与生育方案基因检测...
- 【佳学基因检测】畸形精子症的基因检测质量的评价标准...
- 【佳学基因检测】中国男性生育力保存专家共识及基因检测标准...
- 【佳学基因检测】先天性输精管缺如(CAVD)深度基因检测...
- 【佳学基因检测】梗阻性无精子症深度专项基因检测...
- 【佳学基因检测】Y染色体微缺失基因检测...
- 【佳学基因检测】重度少精子症专项深度基因检测...
- 【佳学基因检测】非梗阻性无精子症基因检测机构推荐...
- 【佳学基因检测】大头精子症基因检测机构介绍...
- 【佳学基因检测】前列腺炎基因检测机构介绍...
- 【佳学基因检测】附睾囊肿基因检测机构介绍...
- 【佳学基因检测】小阴茎(Microphallus)基因检测机构介绍...
- 【佳学基因检测】阴囊缺如(Absent scrotum)基因检测机构介绍...
- 【佳学基因检测】阴囊疼痛(Scrotal pain)基因检测机构介绍...
- 【佳学基因检测】睾丸发育不全基因检测机构介绍...
- 【佳学基因检测】隐睾症基因检测机构介绍...
- 【佳学基因检测】青春期后巨睾症基因检测机构介绍...
- 【佳学基因检测】睾丸间质细胞增生症基因检测机构介绍...
- 【佳学基因检测】睾丸微结石(Testicular microlithiasis)基因检测机构介绍...
- 【佳学基因检测】睾丸肿瘤基因检测机构介绍...
- 【佳学基因检测】睾丸肿块基因检测机构介绍...
- 【佳学基因检测】单侧隐睾基因检测机构介绍...
- 【佳学基因检测】双侧隐睾症基因检测机构介绍...
- 来了,就说两句!
-
- 最新评论 进入详细评论页>>



