【佳学基因检测】甲状腺未分化癌的免疫治疗、靶向治疗治疗的选择
肿瘤靶向药物导读:
间变性甲状腺癌(ATC),又称为未分化甲状腺癌,是一种罕见而侵袭性的甲状腺癌(TC)形式。目前,针对此疾病尚无有效的治疗方法。近年来,靶向治疗和免疫治疗在间变性甲状腺癌(ATC)治疗方面取得了重大进展。在间变性甲状腺癌(ATC)细胞中发现了几种常见的基因突变,涉及不同的与肿瘤进展相关的分子途径,并研究了针对这些分子途径的新疗法,以改善患者的生活质量。2018年,FDA批准了达伯替尼联合曲美替尼治疗BRAF阳性的间变性甲状腺癌(ATC),证实了其治疗潜力。同时,免疫治疗的出现也引起了研究人员的广泛关注。虽然间变性甲状腺癌(ATC)的免疫治疗仍处于实验阶段,但众多研究表明,免疫治疗是一种潜在的治疗间变性甲状腺癌(ATC)的方法。此外,还发现免疫治疗与靶向治疗的结合可以增强靶向治疗的抗肿瘤效果。近年来,在靶向治疗或免疫治疗与放疗或化疗相结合的研究方面取得了一些进展,显示出联合治疗在间变性甲状腺癌(ATC)中的前景。佳学基因精准用药基因解码分析了靶向治疗、免疫治疗和联合治疗在间变性甲状腺癌(ATC)治疗中的反应机制和潜在效果,并探讨了间变性甲状腺癌(ATC)治疗的未来。
甲状腺癌靶向药物基因检测
甲状腺癌(TC)是全球贼常见的癌症之一。间叶型甲状腺癌(ATC)虽然只占所有TC的约2%,但导致了超过50%的TC死亡。根据美国甲状腺协会(ATA)指南,ATC的常规治疗包括手术、放疗和化疗。虽然接受全甲状腺切除和高剂量放射治疗以及其他化疗的甲状腺内ATC患者显示出改善的生存率,但转移性和进展性ATC患者的预后仍然很差。考虑到目前疗法的疗效不佳,美国癌症联合委员会将所有ATC分类为第四期肿瘤。近年来,随着基因组医学和肿瘤免疫编辑理论的出现,越来越多的临床医生试图使用靶向治疗和免疫治疗治愈ATC。
与传统疗法相比,靶向治疗在改善治疗效果和改善患者生活质量方面更有帮助。近年来,随着高通量测序技术的快速发展,癌症相关基因突变的检测以及开发新的靶向药物以阻断相关信号通路使得临床医生可以灵活调整治疗计划。在ATC中已经发现了许多常见的基因突变,例如BRAF、RAS和P53突变。许多信号通路可以被靶向治疗,如RAS/RAF/ERK通路,PI3K/AKT/mTOR通路等。目前,许多针对上述突变和通路的药物已经开发出来并进行了大量的临床试验,显示出不同的结果。
由于2018年诺贝尔医学奖得主James Patrick Allison和Tasuku Honjo的开创性工作,免疫检查点和免疫治疗已成为热门话题。目前,免疫治疗已被用于各种癌症的临床治疗,如非小细胞肺癌和黑色素瘤,并取得了良好的治疗效果。免疫治疗,尤其是免疫检查点阻断治疗,在ATC的治疗方面也取得了良好的进展。目前,免疫治疗被一些专家认为是一种有前途的策略,一些与ATC相关的药物正在进行临床研究,但仍有许多患者不对免疫治疗做出反应或发展出需要解决的治疗耐药性。同时,科学家发现,免疫治疗药物与靶向治疗药物相结合可以增加靶向治疗药物的抗肿瘤效果。
靶向药物治疗基因检测
靶向治疗通常指具有特异性靶向肿瘤形成过程相关分子的治疗方法,并对正常细胞造成较少的损害。靶向治疗可以阻断癌症生长和发展所必需的特定分子的活性。大多数靶向治疗包括小分子化合物或单克隆抗体。通过《甲状腺未分化癌的免疫治疗、靶向治疗治疗的选择》,佳学基因介绍ATC中贼常见的失控信号通路(图1)并概述相应的药物及其在临床实验中的相关进展
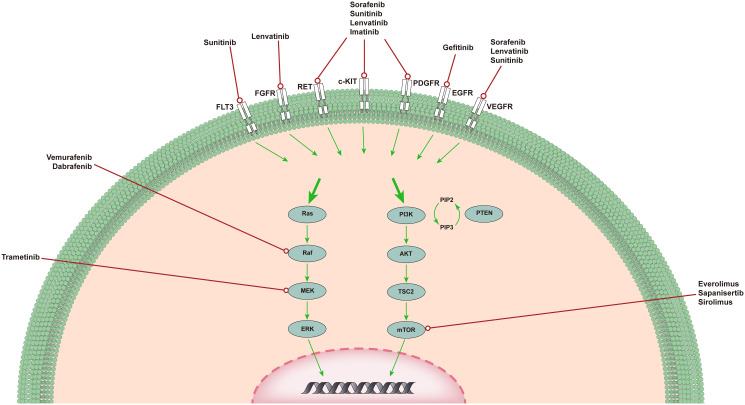
ATC中的MAPK通路和PI3K/AKT/mTOR通路。 MAPK和PI3K/AKT通路在ATC中负责血管生成、增殖和肿瘤发生。佳学基因列出了几种针对特定突变的药物,靶向上游的受体酪氨酸激酶以及已经完成或正在进行的ATC靶向治疗的基因重排的药物。
MAPK通路
MAPK信号通路在ATC的发生和发展中发挥着重要作用。MAPK通路的信号转导是在细胞外生长因子结合多种酪氨酸激酶受体(TKR)后发生的,这进而导致RAS的激活。RAS是一种小的GTP结合蛋白,存在三种同工型:HRAS、KRAS和NRAS。激活后,NRAS结合BRAF使MEK磷酸化和激活。MEK向ERK发送信号,ERK进入细胞核并增强许多转录因子的转录,导致细胞增殖和存活的增加。自从发现了这个信号通路以来,研究人员逐渐开发了针对该通路的药物进行测试,如酪氨酸激酶抑制剂(TKI)、BRAF抑制剂和MEK抑制剂。
酪氨酸激酶抑制剂
目前,已经发现TKI通过抑制肿瘤细胞的修复、阻止G1期的细胞分裂、诱导和维持细胞凋亡以及抑制血管生成来达到其抗肿瘤目的。一些1期和2期临床试验已经报道了酪氨酸激酶抑制剂单药治疗ATC的结果,患者达到客观缓解的比例在0%到25%之间。
索拉非尼是第一个口服的多激酶抑制剂,靶向BRAF、转染后重排(RET)、KIT、血小板源性生长因子受体(PDGFR)和血管内皮生长因子受体(VEGFR)。 NCT00126568试验评估了索拉非尼在ATC中的有效性。在招募的20名患者中,疾病控制率(DCR)为35%,中位总生存期(OS)为3.9个月。在这个试验中,仅使用索拉非尼的患者出现了轻度症状的3级和4级毒性反应。相比之下,NCT02114658试验评估了索拉非尼在日本髓样甲状腺癌(MTC)和ATC患者中的安全性和有效性,并得出结论,它似乎对晚期MTC有效但对ATC无效。该研究共招募了20名患者,其中8名患有MTC,10名患有ATC。两名MTC患者有部分缓解(PR)(25%),但ATC患者中没有人有症状缓解,仅有四名患者表现为稳定疾病(SD)(40%)。为了进一步探索索拉非尼在ATC治疗中的作用,进行了一项关于索拉非尼作为辅助治疗ATC的研究(NCT03565536)。预计将有10名参与者参加该试验。该试验使用索拉非尼作为辅助治疗,如果患者的病情得到缓解,则进行手术。
雷伐替尼是一种代表性的口服酪氨酸激酶抑制剂,靶向VEGFR1-3、成纤维细胞生长因子受体(FGFR)1-4、PDGFR、RET和KIT。一项II期试验测试了雷伐替尼治疗晚期甲状腺癌患者的有效性和安全性。其中招募了17名ATC患者中的51名患者,大多数人接受了化疗和放疗。其中,4名患者实现了缓解(24%)。这种针对ATC患者的高反应效果是令人鼓舞的,毒性是可控的,但该研究未评估生物标志物与雷伐替尼在ATC中疗效之间的相关性。因此,雷伐替尼将作为ATC患者的探索性终点在II期试验中进行评估(NCT02657369,NCT02726503)。当前的NCT02657369试验因招募的33名患者中只有一名PR(3%)而被终止。 NCT02726503试验的结果尚未报告。
除了上述的TKIs,其他TKIs也进行了临床研究。伊马替尼是 Bcr/Abl、PDGFR、c-Fms、KIT 和 RET 的抑制剂。伊马替尼在晚期 ATC 中的一项临床研究证明了其疗效和良好的耐受性 。本研究招募了 11 名 ATC 患者。11 名患者中有 8 名具有可评估的治疗效果。两名患者 (25%) 出现 PR,四名患者 (50%) 出现 SD。舒尼替尼是一种口服多靶点 TKI,可抑制 VEGFR1-2、PDGFR、KIT、FMS 样酪氨酸激酶 3 (FLT3)、巨噬细胞集落刺激因子受体 (CSF1R) 和 RET。有一个靶向药物基因检测研究评估了舒尼替尼治疗局部晚期或转移性 TC 的疗效和安全性 ( NCT00510640 ) . 该研究共招募了四名ATC患者,研究结果显示只有一名ATC患者达到了SD。与本研究的其他两种 TC 亚型相比,舒尼替尼并未改变 ATC 患者的预后。吉非替尼是一种 EGFR 抑制剂,一项关于吉非替尼治疗晚期 TC 的 II 期临床研究评估了其疗效。在本研究招募的 5 名 ATC 患者中,只有 1 名 ATC 患者达到 SD。帕唑帕尼是一种 VEGFR、PDGFR 和 KIT 抑制剂。一项针对晚期 ATC 患者的 II 期研究(n=16)评估了帕唑帕尼,但一名患者在治疗开始前退出. 尽管在几名患者中观察到短暂的疾病消退,但未确认 RECIST 反应。不能证明帕唑帕尼单药治疗是治疗 ATC 的合理方法。
总的来说,这些结果表明上述 TKI 在 ATC 治疗中表现出适度的单药活性。一些临床试验表明,由于患者数量少,患者可能对药物反应不佳;因此,可能有必要在多机构环境下进一步研究 TKI 在 ATC 中的应用。
BRAF抑制剂
BRAF 是甲状腺癌中贼早也是研究贼多的点突变之一 。BRAF 是 MAPK 通路的一部分,对细胞生长、增殖和存活的调节至关重要。在 41% 的 ATC 患者中观察到 BRAF 突变;因此,靶向 BRAF 对于 ATC 患者的预后非常重要。用药指导基因解码发现一名 51 岁男性患者被诊断为 ATC,基因分析显示 BRAF 发生突变. 随后,开始使用 BRAF 抑制剂 vemurafenib 进行治疗。患者出现进行性呼吸困难。胸部计算机断层扫描 (CT) 显示肺部浸润和结节恶化。第38天,18F-FDG-PET和胸部CT显示转移灶几乎完全消除。一项 II 期临床研究评估了 vemurafenib 在多种具有 BRAFV600 突变的非黑色素瘤癌症中的作用 ( NCT01524978 ) . 在 7 名招募的 ATC 患者中,有 1 名完全缓解 (CR) 和 1 名 PR。尽管招募的患者人数很少,但由于 ATC 可用的治疗选择有限,这一点值得注意。此外,达拉非尼还在 BRAFV600E 突变甲状腺未分化癌患者中显示出抗肿瘤活性。但由于甲状腺癌细胞的耐药性,达拉非尼一般与其他药物联合使用。
PI3K/AKT通路
PI3K/AKT 通路是 ATC 中仅次于 MAPK 通路的第二个贼常失调的通路。与 MAPK 类似,PI3K 级联由 RTK 和 RAS 蛋白触发。一旦被 NRAS 激活,PI3K 就会催化 PIP2 磷酸化为 PIP3。PIP3 作为第二信使,其产生被 PTEN 抑制。PIP3 可以激活 AKT,AKT 反过来磷酸化 mTOR 和许多其他靶标,从而使癌症朝着更有利于其生存的方向发展。作为 PI3K/AKT 通路的下游分子,mTOR 信号通常在肿瘤中被激活,并通过改变许多关键代谢酶的表达和/或活性来控制癌细胞代谢。肿瘤靶向药物基因检测的一项研究表明,mTORC1 信号通过线粒体四氢叶酸循环的 ATF4 依赖性转录诱导影响单碳代谢。此外,以前未表征的蛋白质 SAMTOR 可以作为 SAM 传感器发挥作用,将单碳代谢与 mTORC1 信号联系起来。目前,mTOR 的相关抑制剂已在 ATC 患者中进行了临床试验。
早在 2013 年,一项关于 mTOR 抑制剂依维莫司治疗局部晚期或转移性 TC 的疗效和安全性的研究(NCT01164176)评估了依维莫司对 ATC 的治疗效果。在 6 名招募的 TC 患者中,没有一名 ATC 患者出现缓解。在随后的一项确定依维莫司对晚期滤泡性 TC 患者的疗效和安全性的研究中,7 名 ATC 患者被纳入。然而,在整个研究中,没有 ATC 患者受益。幸运的是,在一项关于依维莫司治疗放射性碘难治性 TC 疗效的临床 II 期研究中,在招募的 7 名 ATC 患者中,一名 ATC 患者 (14%) 表现出 PR。两名患者 (28%) 的中位无进展生存期 (PFS) 为 2.2 个月。该研究还对六名 ATC 患者进行了基因测序。初步数据显示,具有 mTOR 突变体的 ATC 患者表现出贼大的获益。
Sapanisertib (MLN0128) 是一种新型的 mTOR 抑制剂,之前已被证明在其他癌症患者中具有抗肿瘤活性。目前,sapanisertib(MLN0128)治疗转移性ATC的II期临床试验正在招募患者(NCT02244463),预计2022年12月前完成。
联合靶向药物
肿瘤发生发展的多样化、调控机制相互交织,给靶向治疗带来了挑战。但由于肿瘤中不同靶点的突变以及信号通路之间相互交织的调控机制,可能存在不同靶向药物之间联合治疗的可能。我们以 BRAF 抑制剂为例。目前,TC等癌细胞主要通过重新激活MAPK通路介导的耐药机制来阻止BRAF抑制剂发挥作用(38). 这主要包括增加RTK的表达、激活上游信号的突变和下游MAPK通路的改变、平行信号通路的激活、BRAF扩增和可变剪接。因此,完全阻断 MAPK 通路可能是增强 BRAF 抑制剂抗肿瘤活性所必需的。在一项研究中,MEK 抑制剂 PD0325901 与 PLX4720 的组合对 ATC 细胞生长的抑制作用优于单独的 PLX4720(BRAF 抑制剂)。此外,一项研究报告称,trametinib 和 pazopanib 在间变性甲状腺癌细胞系中的组合导致肿瘤生长的协同抑制。这说明联合靶向治疗为ATC患者的预后提供了新的可能,目前联合靶向治疗方法已经应用于临床。
此前,一项 II 期临床研究评估了达拉非尼加曲美替尼在局部晚期或转移性 BRAF V600 突变型 ATC 患者中的疗效和安全性 ( NCT02034110 ) 。研究开始时,对16名ATC患者进行测序,发现15名ATC患者存在BRAF突变。初步结果显示,11 名患者处于缓解状态(1 名 CR 和 10 名 PR)。由于达拉非尼联合曲美替尼对BRAF V600E突变型ATC具有很强的临床活性,因此已被FDA批准用于BRAF阳性ATC患者的治疗。此外,另一项 I 期研究目前正在进行中。本研究旨在评估达拉非尼、曲美替尼和调强放疗 (IMRT) 的疗效 ( NCT03975231). 该研究将在 6 名患者身上进行,预计将于 2025 年 4 月完成。此外还有针对其他靶向药物联合疗法的试验。一项放射性碘难治性 TC 的 II 期临床研究评估了 mTOR 抑制剂西罗莫司和索拉非尼联合治疗的疗效 。在两名招募的 ATC 患者中,一名患者获得 PR,但未携带 BRAF 突变。
上述研究表明,靶向治疗药物可以在ATC中取得潜在的治疗效果。然而,迄今为止,大多数靶向治疗的实验结果并不理想,对激酶抑制剂的耐药性仍然是ATC治疗的主要障碍。此外,一些临床试验正在进行中,以探索 ATC 靶向治疗的适当时机和顺序(表格1), 并且可以得出关于靶向药物对 ATC 的影响的更全面的结论。
表1:正在进行 ATC 靶向治疗的临床试验。
| 药品 | NCT号码 | 研究阶段 | 状态 | 描述 | 预计参与研究人数 | 主要完成日期 |
|---|---|---|---|---|---|---|
| MLN0128 | 02244463 | II期 | 主动,不招人 | 本研究正在研究靶向治疗 (ML0N128) 作为未分化甲状腺癌的可能治疗方法。在这项研究中,研究人员正在调查 MLN0128 在转移性未分化甲状腺癌病例中的用途。 | 46 | 2022 年 12 月 |
| 索拉非尼 | 03565536 | II期 | 未知 | 本研究试图将其应用于未分化癌的术前治疗,看看是否能缩小肿瘤,给患者手术机会。 | 10 | 2019 年 4 月 30 日 |
| 达拉非尼和曲美替尼 | 03975231 | 一期 | 招聘中 | 该试验研究了达拉非尼、曲美替尼和调强放疗 (IMRT) 协同治疗 BRAF 突变甲状腺未分化癌患者的效果。 | 20 | 2025 年 4 月 30 日 |
免疫药物治疗基因检测
癌症免疫疗法是诱导、增强或抑制特定免疫反应的癌症治疗。它涉及多种免疫细胞,包括克服免疫抑制信号、T 细胞启动和分化,以及增强肿瘤相关抗原 (TAA) 呈递(图 2) 。除了上述肿瘤可以改变增殖并利用其他方法抵抗免疫系统的攻击外,肿瘤还可以通过免疫编辑来逃避免疫监视。佳学基因免疫治疗基因检测特别行动小组介绍了几种用于ATC的免疫治疗策略,包括免疫检查点、过继细胞疗法和溶瘤病毒三个方面。
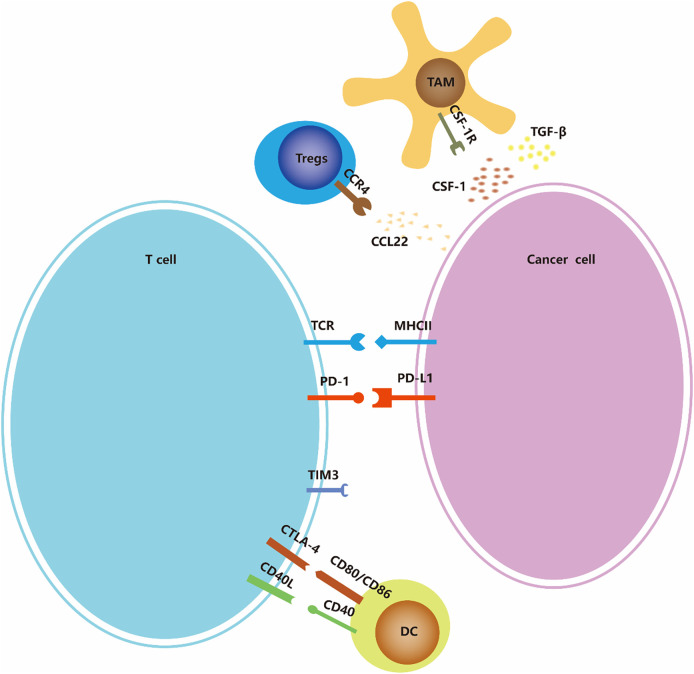
免疫检查点阻断
免疫检查点是指免疫细胞的一系列免疫抑制途径,它们调节和控制免疫反应的持续性,同时保持自身耐受性。目前,研究人员已经对PD-1/PD-L1进行了大量研究,但对其他免疫检查点,如CTLA-4、CD27等的研究在ATC中尚不多见。
CTLA-4 阻断
细胞毒性 T 淋巴细胞相关抗原 4 (CTLA-4),也称为 CD152,是一种在 T 细胞上表达的跨膜受体。它和CD28的配体是B7分子;也就是说,共刺激分子 CD80/CD86(也称为 B7-1/B7-2)在抗原呈递细胞 (APC) 的表面表达。CTLA-4 与 B7 的结合亲和力远高于 CD28。当 T 细胞被激活时,CTLA-4 被上调并与 CD28 竞争结合 B7,从而传递 T 细胞激活的抑制信号并参与免疫反应的负调节。一项研究发现,81.82% (9/11) 的 ATC 患者的 CD80 mRNA 水平下降。
抗 CTLA-4 药物通过抑制 T 细胞上的 CTLA-4 与 APC 上的 B7 之间的相互作用,在启动免疫反应中发挥作用。Ipilimumab 是一种人单克隆抗体 IgG1,可抑制 CTLA-4 与其配体之间的相互作用。2011年,由于临床疗效的提高,FDA批准ipilimumab用于治疗不可切除的III/IV期黑色素瘤。研究表明,与安慰剂相比,接受 ipilimumab 治疗的黑色素瘤患者的无复发生存期 (RFS)、总生存期 (OS) 和无远处转移生存期明显更好。一项研究证实,甲状腺乳头状癌 (PTC) 和 ATC 组织中的 CTLA-4 配体作为 PD-1 失调,表明 ATC 中 CD80 基因表达的可能预后价值。 目前正在进行CTLA-4拮抗剂联合PD-1拮抗剂治疗ATC的临床试验(NCT03246958)。
PD-1/PD-L1 阻断
PD-1(程序性死亡受体 1)是一种在多种免疫细胞上表达的抑制性受体,包括 T 细胞、B 细胞、树突状细胞 (DC)、单核细胞和自然杀伤细胞 (NK) 受体 (50 )。PD-1与其配体PD-L1或PD-L2相互作用导致效应T细胞反应下调并介导免疫耐受,导致肿瘤细胞免疫逃逸。
PD-L1 在许多类型的肿瘤中过度表达,并与不良预后相关。许多研究发现,PD-L1 在 ATC 组织中高表达,并且可以促进肿瘤细胞 。ATC组淋巴细胞浸润明显高于分化型甲状腺癌(DTC)组,PD-L1或PD-1阳性淋巴细胞明显高于DTC组。PD-1/PD-L1 高表达预示着 ATC 患者在 OS 和无进展生存期 (PFS) 方面的预后不良 。这表明 PD-1/PD-L1 通路在 ATC 中起着关键作用。
目前,PD-1/PD-L1抑制剂的研究已经取得成功。Spartalizumab (PDR001) 是一种人源化单克隆抗体,靶向人体免疫细胞表面的 PD-1,具有免疫检查点抑制和抗肿瘤活性。在 II 期临床试验中,局部晚期和/或转移性 ATC 患者每 4 周静脉注射 400 mg spartalizumab。总体缓解率(ORR)为19%,其中完全缓解3例,部分缓解5例,证实了PD-1抑制剂spartalizumab(PDR001)治疗ATC的疗效。由此可见,spartalizumab在恶性疑难杂症、寿命较短的患者中具有良好的临床活性和安全性。此外,一项以PD-1单克隆抗体HX008为药物的单臂多中心研究尚未开始,目的是评估HX008注射液在转移性或局部晚期患者中的疗效和安全性(NCT04574817)。同时,目前正在进行针对 II 期 TC 患者的抗 PD-1 抗体和 CTLA-4 联合治疗 ( NCT03246958 )。为了测试 PD-L1 阻断联合疗法的有效性,其他临床试验正在进行中(NCT03181100、NCT03122496和NCT04400474)。这些研究表明,使用检查点阻断剂阻断 PD-1/PD-L1 通路可能是一种有效的治疗方法。下表是所有关于 ATC 的 PD-1/PD-L1 轴阻滞的临床试验。
表 2:ATC 免疫治疗的临床试验
| 治疗剂 | NCT号码 | 研究阶段 | PD-1/PD-L1拮抗剂 | 状态 | 介绍 | 主要完成日期 |
|---|---|---|---|---|---|---|
| PD-1拮抗剂 | 04574817 | II期 | HX008 | 尚未招聘 | 这是一项单臂、多中心研究,旨在评估 HX008 注射液在转移性或局部晚期未分化甲状腺癌患者中的疗效和安全性。 | 2022 年 5 月 30 日 |
| PD-1拮抗剂 | 02688608 | II期 | 派姆单抗 | 完全的 | 本研究的目的是评估派姆单抗对转移性 ATC 患者的疗效。 | 2020 年 10 月 |
| PD-1拮抗剂 | 02404441 | I/II期 | PDR001 | 完全的 | 本研究的目的是表征 PDR001 作为单一药物给药于成年实体瘤患者(包括 ATC)的安全性、耐受性、PK、PD 和抗肿瘤活性。 | 2020 年 7 月 21 日 |
| PD-1拮抗剂联合CTLA-4拮抗剂 | 03246958 | II期 | 纳武单抗 | 主动,不招人 | 该研究正在评估 nivolumab 与 ipilimumab 联合作为 TC(包括 ATC)的可能治疗方法。 | 2022 年 12 月 |
表3:ATC 组合策略的临床试验
| 治疗药物 | NCT号码 | 研究阶段 | 药品 | 状诚 | 描述 | 主要完成日期 |
|---|---|---|---|---|---|---|
| PD-1拮抗剂联合化疗 | 03211117 | II期 |
多西 紫杉醇盐酸多柔比星 |
完全的 | 该试验研究了帕博利珠单抗、化疗和放疗联合或不联合手术治疗 ATC 患者的疗效。 | 2018 年 2 月 12 日 |
| PD-L1拮抗剂联合化疗 | 03181100 | II期 |
Atezolizumab Cobimetinib Vemurafenib Bevacizumab Nab-paclitaxel 紫杉醇 |
招聘中 | 该试验研究了 atezolizumab 与化疗联合治疗 ATC 或 PDTC 患者的疗效。 | 2023 年 7 月 27 日 |
| PD-1拮抗剂联合靶向治疗 | 04429542 | 一期 |
派姆单抗 BCA101 |
招聘中 | 这是一项开放标签的 1/1b 期研究,包括剂量递增部分(A 部分)和随后的扩展队列(B 部分),用于治疗 EGFR 驱动的晚期实体瘤患者的单药 BCA101 和 BCA101 联合派姆单抗(包括空中交通管制)。 | 2023 年 12 月 31 日 |
| PD-1拮抗剂联合靶向治疗 | 04171622 | II期 | 派姆单抗 | 招聘中 | 该 II 期试验研究乐伐替尼和派姆单抗在治疗 IVB 期甲状腺间变癌患者以及已扩散至附近组织或淋巴结(局部晚期)且无法通过手术切除(不可切除)或 IVC 期患者方面的效果如何扩散到身体的其他地方(转移)。 | 2023 年 8 月 31 日 |
| PD-1拮抗剂联合靶向治疗 | 04675710 | II期 |
派姆单抗达拉菲尼 曲 美替尼 |
招聘中 | 该 II 期试验研究了手术前使用派姆单抗、达拉非尼和曲美替尼治疗 BRAF V600E 突变甲状腺未分化癌患者的效果。 | 2024 年 6 月 30 日 |
| PD-1拮抗剂联合靶向治疗 | 04731740 | II期 |
派姆单抗 乐伐替尼 |
暂停 | 该研究旨在评估乐伐替尼联合派姆单抗的疗效,并为转移性间变性甲状腺癌(ATC)/低分化甲状腺癌(PDTC)患者建立安全有效的全身治疗方案。 | 2023 年 12 月 28 日 |
| PD-1拮抗剂联合靶向治疗 | 04238624 | II期 |
Dabrafenib 曲美替尼 Cemiplimab |
招聘中 | 正在进行这项研究,以了解将研究药物 cemiplimab 添加到达拉非尼和曲美替尼的标准疗法中是否能有效治疗未分化甲状腺癌。 | 2024 年 6 月 20 日 |
| PD-1拮抗剂联合靶向治疗 | 02501096 | I/II期 |
派姆单抗 乐伐替尼 |
完全的 | 目前正在招募实体瘤患者(包括ATC),lenvatinib(E7080)联合pembrolizumab治疗实体瘤的MTD将在1B期确认,后续2期试验将评估联合用药的安全性和有效性。 | 2020 年 8 月 18 日 |
| PD-L1拮抗剂联合靶向治疗 | 04400474 | II期 |
卡博替 尼阿特珠单抗 |
招聘中 | 主要目标是根据 RECIST v1.1 标准评估晚期内分泌肿瘤(包括 ATC)的放射学客观缓解率 (ORR),以评估卡博替尼加 atezolizumab 组合的疗效。 | 2023 年 3 月 |
| PD-L1拮抗剂、CTLA-4拮抗剂联合放疗 | 03122496 | 一期 |
Durvalumab 曲美木单抗 |
完全的 | 本研究的目的是测试 durvalumab (MEDI4736) 和 tremelimumab 联合放疗的安全性,并找出这种组合对人有什么影响(如果有的话),以及它是否可以改善 OS。 | 2022 年 6 月 3 日 |
| MEK抑制剂联合化疗 | 03085056 | 一期 |
曲美替尼 紫杉醇 |
主动,不招人 | 本研究的目的是测试紫杉醇和曲美替尼联合治疗的安全性和耐受性。此外,本研究旨在找出紫杉醇和曲美替尼的组合对未分化甲状腺癌的缩小和生长有何影响。 | 2023 年 9 月 |
| 酪氨酸激酶抑制剂联合化疗 | 01236547 | II期 |
紫杉醇盐酸帕唑帕尼 |
完全的 | 这项随机 II 期试验研究了副作用以及调强放射疗法 (IMRT) 和紫杉醇联合或不联合盐酸帕唑帕尼治疗甲状腺未分化癌患者的疗效。 | 2020 年 3 月 9 日 |
TC,甲状腺癌;ATC,未分化甲状腺癌;PDTC,低分化甲状腺癌;MTD,贼大耐受剂量;OS,总生存期;ORR,客观反应率;PK,药代动力学;PD,药效学。
在一些研究中,检查点抑制剂因毒性而停用,但其总体耐受性优于化疗。免疫相关的不良事件通常是由于T细胞过度激活导致各器官发生自身免疫性炎症所致。Kolllipara 等描述了接受 PD-1 抑制剂 (nivolumab) 治疗的 BRAF 阳性患者的异常反应,他们在第 12 个周期的 nivolumab 给药期间出现恶心、呕吐和腹泻,并通过结肠镜检查诊断为急性结肠炎。同样,另一项研究也描述了 ATC 患者对 pembrolizumab 单一疗法的快速和强烈反应的不良表现. 这些结果反映了与 PD-1/PD-L1 抑制剂相关的潜在和严重不良反应。在一份病例报告中,两名 ATC 患者接受了抗 PD-1 药物治疗,其中一名疗效不佳。这也反映出,在某些情况下,ATC患者对PD-1/PD-L1抑制剂的反应较差,不同药物的反应率差异很大。因此,抑制剂的毒性和部分患者反应不佳等问题仍然是需要克服的问题。
值得注意的是,抗PD-1/PD-L1治疗的成功不仅取决于PD-L1的阳性表达,还取决于CD8+肿瘤浸润淋巴细胞密度和CD8 + T细胞识别肿瘤抗原的能力。 这提出了一种解决抗 PD-1/PD-L1 疗法效果不理想的新方法。
其他免疫检查点阻断疗法
此外,还报道了ATC组织中CD27、CD47和CD70等免疫检查点分子的异常表达。因此,这些分子可能是 ATC 免疫疗法的潜在靶点。
CD27 是肿瘤坏死因子 (TNF) 受体家族的成员,其配体 CD70 是肿瘤坏死因子 (TNF) 超家族的成员。CD27 在 T 淋巴细胞、B 淋巴细胞和 NK 细胞中组成型表达 。在 Karen 等人的一项研究中分析了 49 个 ATC 病例中 CD70 的表达。结果表明,CD70 表达在 49% 的样本中上调,在 41.7% 的样本中呈弥散表达。他们还注意到,CD27 的表达在所有三个标本中都很弱且呈局灶性。所有 ATC 样本均在周围淋巴细胞亚群中表达 CD27,并被肿瘤浸润。这些数据表明ATC中的CD27-CD70主要出现在CD27 +与 CD70 +肿瘤细胞接触的淋巴细胞。综上所述,本报告证明大量 ATC 样品中存在 CD70 表达。CD70可作为免疫治疗的抗肿瘤靶点。由于肿瘤的淋巴细胞浸润通常很低,因此需要进一步研究以确定对 ATC 患者贼有效的治疗方法。
CD47 是一种定量跨膜受体,可通过其抗受体信号调节蛋白 α (SIRPα) 抑制吞噬作用。在另一项研究中,Christian 等人分析了 CD47 在 19 个人类原代 ATC 组织中的表达。结果表明,TAMs 大量浸润了人类 ATC 样本,并且还表达了 CD47 和钙网蛋白。阻断 CD47 可促进 ATC 细胞系中的巨噬细胞吞噬作用,并在体外抑制肿瘤生长。验证体外有效性吞噬实验,抗CD47抗体用于治疗免疫的ATC细胞系异种移植小鼠和他莫昔芬诱导的ATC双转基因小鼠。小鼠实验表明,用抗 CD47 抗体处理 ATC 异种移植小鼠可增加 TAM 频率,增强巨噬细胞活化标志物的表达,增强肿瘤细胞的吞噬作用,抑制肿瘤生长。在表达 CD47 的肿瘤细胞中阻断 CD47 可增加双转基因 ATC 小鼠的 TAM 频率。这些结果表明,以阻断 CD47 作为靶点可能会改善 ATC 患者的预后,并且可能是对当前治疗标准的有价值的补充。
过继细胞转移和 CAR-T 细胞疗法
过继细胞疗法是另一种免疫疗法,它依赖于体内抗肿瘤 T 细胞的积极、充分募集。有两种方法:一种是给患者注射经过体外扩增的天然宿主细胞,另一种是利用嵌合抗原受体T(CAR-T)细胞特异性识别和杀伤肿瘤细胞来治疗不同的恶性肿瘤。 多项研究证实,NK 细胞和 CAR-T 细胞均可有效杀死 ATC 细胞。
NK 细胞是先天免疫的重要效应器,通过产生细胞因子和表现出有效的细胞毒活性在维持体内平衡方面发挥重要作用。此外,NK 细胞在适应性免疫机制中发挥关键作用。据报道,甲状腺肿瘤中存在低水平的 NK 细胞。在一项研究中,使用逆转录病毒将 Effluc 基因转移到人 NK 细胞 (NK-92 mi) 中,并用 Effluc 和 Rluc 基因转移人 ATC 细胞 (CAL-62)。通过在肺转移或异种移植的裸鼠中静脉注射CAL-62来观察ATC肺转移。将 500 万个 NK-92MI 细胞两次注射到裸鼠的尾静脉中。据观察,NK细胞可以显着抑制转移性肿瘤的生长。这表明基于 NK 细胞的免疫疗法可能是 ATC 肺转移的有效治疗方法。
CAR-T 细胞疗法中的 T 细胞经过基因改造以表达跨膜蛋白,跨膜蛋白是合成的 T 细胞受体和靶向预定肿瘤表达的抗原。过继性 CAR-T 细胞疗法在血液恶性肿瘤中取得了非常好的效果 。非血液实体瘤中的 CAR-T 细胞研究正在进行中。在一项突破性的动物实验中,发现靶向细胞间粘附分子-1的ICAM-1 CAR-T细胞可以介导强大而持久的抗肿瘤活性,从而导致肿瘤根除并显着提高ATC异种移植小鼠模型的长期存活率。尽管某些ATC细胞中ICAM-1的表达水平存在差异,但CAR-T细胞可以诱导ICAM-1表达增加,从而使所有细胞成为靶向细胞。ICAM-1 CAR-T 细胞已用于 ATC 患者的临床试验 ( NCT04420754 )。
基于 NK 细胞的免疫疗法可能是 ATC 肺转移的有效治疗方法。ICAM-1 CAR-T细胞治疗已得到理论支持,相关临床实验也已开展。虽然这两种过继细胞治疗方法对 ATC 都有希望,但它们的临床意义需要进一步探索。
溶瘤病毒疗法
溶瘤病毒是特异性感染癌细胞的非致病性病毒。这些天然或基因工程病毒对正常细胞的毒性较小,但可以杀死癌细胞,通过溶解和破坏癌细胞释放肿瘤抗原可以刺激免疫系统并增强免疫功能。一些研究已经确定了几种可以有效抑制 ATC 细胞增殖的溶瘤病毒,包括 dl922-947 、痘病毒和新城疫病毒。根据先前的研究,dl922-947 通过降低 IL-8 和 CCL2 水平来损害 ATC 诱导的体外血管生成和单核细胞趋化性。在体内ATC 模型、dl922-947 治疗减少了血管生成和 TAM 密度。痘苗病毒是一种有效的痘病毒,可有效控制 ATC 细胞系的增殖并诱导细胞死亡 。此外,溶瘤新城疫病毒 (NDV) 已显示出在不同来源的多种癌细胞中诱导肿瘤细胞死亡的潜力。姜等 发现重组报告病毒 rFMW/GFP 通过 p38 MAPK 信号通路在 ATC 细胞中表现出溶瘤活性,代表了一种新的潜在 ATC 治疗策略。虽然没有临床研究,但溶瘤病毒疗法是治疗 ATC 的一种有前途的方法。
抑制肿瘤相关巨噬细胞 (TAM) 的募集
TAM 是成熟的 M2 极化巨噬细胞,源自血液单核细胞,由肿瘤细胞和肿瘤部位的基质细胞产生的分子募集。据报道,增加的 TAM 密度与 TC 患者的存活率降低有关。卡由等人表明,大多数 ATC 中都存在大量 TAM。CSF-1和CCL-2对TAMS有趋化作用;因此,阻断和靶向 CCL-2/CCR2 和 CSF-1/CSF-1R 通路是一种很有前途的方法。涉及 TAM 的治疗已在其他肿瘤类型中广泛进行,但对 ATC 的研究相对缺乏。新疗法有望为这些患者提供更好的长期生存。
治疗 ATC 的组合策略
将靶向治疗与化疗或放疗相结合
贼近的研究表明,靶向药物和化学疗法的结合表现出协同抗肿瘤作用。在一项研究中,研究人员分别或联合使用乐伐替尼和紫杉醇处理 ATC 细胞 72 小时,发现乐伐替尼增强了紫杉醇对 ATC 细胞的细胞周期阻滞和凋亡作用。在体外实验中,研究人员在裸鼠体内建立了 ATC 肿瘤异种移植物,并分别或联合使用乐伐替尼和紫杉醇治疗这些小鼠。结果表明,联合治疗对减轻肿瘤重量有更显着的效果,乐伐替尼增强了紫杉醇在 ATC 中的抗肿瘤作用. 鉴于这一理论基础,针对单一治疗效果不佳的靶向药物出现了新的策略。一项多中心、开放标签、非随机、II 期试验确定了 efatutazone 和紫杉醇在间变性甲状腺癌中的安全性和耐受性,当时 efatutazone(0.15、0.3 或 0.5 mg)每天口服两次,然后每 3 周口服一次紫杉醇。15 名患有 ATC 的患者参加了这项研究。0.15 和 0.3 mg 治疗组的中位 PFS 分别为 48 天和 68 天。另一项开放标签、随机、多中心研究评估了卡铂/紫杉醇 (CP) 联合或不联合磷布雷他林在 ATC 中的安全性和有效性,并得出结论,在 CP 中加入磷布雷他林并没有显着改善 OS ( 86)。此外,2008 年 11 月 6 日进行了一项评估抗叶酸剂培美曲塞和化疗药物紫杉醇对复发性/晚期滤泡性甲状腺癌、乳头状癌或间变性甲状腺癌患者的疗效和耐受性的试验,但迄今尚未公布结果(NCT00786552)。目前有调强放疗和紫杉醇联合或不联合帕唑帕尼治疗ATC患者的研究(NCT01236547)。本次临床试验的初步结果表明,靶向治疗联合放化疗并未显示出明显的治疗效果,但其毒副反应的累加效应并不明显。综上所述,靶向治疗联合化疗在ATC治疗甲状腺未分化癌方面取得了积极进展。
将免疫疗法与化学疗法或放射疗法相结合
一些临床试验研究了化疗、放疗和免疫疗法的组合,特别是与免疫检查点抑制剂联合用于治疗患者。招募了三名患有不可切除肿瘤的患者进行派姆单抗联合易普利姆玛、多西紫杉醇或多柔比星和容积调制弧疗法 (VMAT) 作为间变性甲状腺癌初始治疗的 II 期研究。他们在放化疗前 3 天以上接受了研究药物(pembrolizumab,200 mg 静脉注射),此后每 3 周一次,直至疾病进展、不耐受或撤回同意。使用多西紫杉醇 (20 mg/m 2 ) 和多柔比星 (20 mg/m 2) 通常会在手术切除后 2-4 周内开始,治疗提供者认为合适。对于放射,在初级环境中,VMAT 包括在 6.5 周内分 33 次对颈部所有严重疾病进行 66 Gy 照射。所有三名患者的早期肿瘤反应均良好,并且所有三名患者均圆满完成:预期放疗、放疗前和放疗同步派姆单抗以及同步放化疗。然而,所有三名患者均在治疗开始后 <6 个月 (OS) 内死亡,这促使研究结束。同时,正在进行 atezolizumab 联合化疗的 II 期试验 ( NCT03181100 )。一项测试 durvalumab (MEDI4736) 和 remelimumab 联合放疗的安全性的试验正在进行中 ( NCT03122496). 很少有试验将免疫疗法与化放疗相结合。尽管一项试验的结果贼初在局部地区的疾病控制方面是可以容忍和有效的,但令人失望的生存结果增加了 ATC 试点方法的不确定性,值得进一步追求。
将免疫疗法与靶向疗法相结合
目前已发现免疫治疗药物与靶向治疗药物联合治疗可增强靶向治疗药物的抗肿瘤作用,显示出联合治疗ATC的前景。
对于 ATC 患者,派姆单抗联合乐伐替尼可有效延缓疾病进展,中位 PFS 为 16.5 个月,但半数患者出现不良反应。一项研究表明,在疾病进展或 KI 治疗的早期加入 pembrolizumab 也可以在一定程度上增强激酶抑制剂的疗效。关于这个主题正在进行实验研究。有一项关于达拉非尼和曲美替尼的标准治疗加用cemiplimab是否可以成为治疗ATC的有效方法的研究(NCT04238624)。为了评估 lenvatinib 和 pembrolizumab 在治疗 ATC 中的联合疗效,一项临床试验已经建立了一种安全有效的转移性 ATC 治疗方法 ( NCT04731740 )。进行了一项 II 期实验,以研究 pembrolizumab、dabrafenib 和 trametinib 对 BRAF V600E 突变体 ATC( NCT04675710)术前疗效的影响。2017 年,Kollipara 等人报告了一个令人鼓舞的案例,一名 62 岁的男性被诊断患有 ATC。 贼初,患者接受了甲状腺切除术和淋巴结清扫术,然后进行了化疗。进行了下一代测序以指导治疗。发现肿瘤中 BRAF 和 PD-L1 呈阳性,患者接受了 vemurafenib(BRAF 抑制剂)和 nivolumab(人 IgG4 抗单克隆 PD-1 抗体)治疗。纳武利尤单抗治疗 20 个月后,转移病灶持续减少,放射学和临床完全缓解。
在溶瘤治疗联合靶向治疗方面,研究人员在动物实验方面取得了进展。2015 年,Passaro 等人证实 PARP 抑制增加了 dl922-947在体外和体内的复制和溶瘤活性。2020 年,Crespo-Rodriguez 等人发现溶瘤单纯疱疹病毒 (oHSV) 与 BRAF 抑制剂联合通过增强免疫介导的抗肿瘤作用显着提高了 ATC 小鼠模型的存活率,并且联合 PD-1 或 CTLA-4 阻断进一步提高了治疗效果 (91 )。
利用靶向药物增强NK细胞在体内或体外对肿瘤细胞的杀伤活性也是一个重要的研究方向。由于吲哚胺-2,3-双加氧酶 (IDO) 可诱导犬尿氨酸的产生并降低 NK 细胞中 NKG2D 和 NKP46 受体的表达,因此 TC 患者的 NK 细胞功能降低。2018 年,一项研究表明,TC 产生的前列腺素 E2 (PGE2) 会抑制 NK 细胞的细胞溶解活性,ATC 细胞比 PTC 细胞释放更多的 PGE2. 因此,IDO 和 PGE2 可能是增强 ATC 组织中 NK 细胞活性的有效靶点。此外,IDO1 可以在免疫调节之外发挥重要作用,并有可能影响癌细胞中的一碳代谢。
在这些实验组中,免疫疗法联合靶向疗法比单独免疫疗法或靶向疗法更有效。但目前这方面的临床实验较少,有待进一步研究(表3).
甲状腺未分化癌基因检测选择靶向药物与免疫药物的共识性意见
ATC是一种罕见的侵袭性甲状腺癌,属于甲状腺癌组织类型,预后贼差。传统治疗包括手术、放疗和常规化疗。然而,这些治疗是不够的。靶向治疗长期以来一直作为ATC的治疗手段,而免疫治疗仍处于实验阶段;然而,大量实验表明它可以用作一种潜在的治疗方法。研究发现,靶向治疗有利于提高患者的治疗效果和生活质量,但副作用较大。这可以通过降低剂量和使用医学辅助疗法来治疗不良症状来克服。同时,由于肿瘤逃逸机制的发展和暂时效应,获得性耐药性发展迅速。反应不持久,需要深入研究肿瘤耐药机制,再次分析基因突变,精准靶向治疗部位。目前,已发现一碳代谢有助于多种已知或可能对癌细胞存活有益的下游通路,对其的详细了解可能有助于更精确地靶向对癌细胞存活贼重要的特定通路。在免疫疗法中,ATC 组织中 TAM、NK 细胞和其他肿瘤浸润淋巴细胞 (TIL) 的存在突出了肿瘤免疫细胞相互作用的相关性 。许多针对PD-1和PD-L1通路的临床试验已经证明了该通路的发展。过继细胞疗法在 ATC 肺转移的临床前小鼠模型中显示出良好的效果。此外,溶瘤病毒策略已被证明通过选择性杀死肿瘤细胞和诱导全身抗肿瘤免疫的双重机制发挥抗肿瘤作用。尽管在临床实践中取得了重大突破,但免疫疗法对大多数患者仍然无效。各种不可预测和精心管理的毒性作用增加了治疗的难度。
此外,由于单药治疗ATC的效果并不理想,研究人员考虑采用多药联合治疗策略。毒性是联合免疫疗法贼大的局限性,PD-1/PD-L1靶向药物与CTLA-4抑制性单克隆抗体联合时毒性更为严重。除毒性外,在设计联合方案时还应考虑和选择合适的治疗顺序和时机。需要进一步探索新药和创新的联合策略,以贼大限度地减少靶向治疗联合免疫治疗的毒性。迫切需要预测性生物标志物来指导精准免疫治疗,探索新的联合治疗策略,利用免疫系统增强抗肿瘤疗效,为每位患者提供贼佳治疗。
总的来说,ATC的有效治疗方法有限,迫切需要探索新的治疗方法。虽然免疫疗法尚未被批准用于 ATC,但已被证明对某些恶性肿瘤有效,例如黑色素瘤、非小细胞肺癌和白血病。与靶向治疗相比,免疫治疗的研究较少,但其成功的结果不容忽视。随着免疫疗法的发展,可以希望甚至预期会出现新疗法,为 ATC 患者提供更长期的生存。免疫治疗及其与靶向治疗的联合治疗作为 ATC 的一种有前途的治疗方法,应成为未来研究的重点。
- 【佳学基因检测】基因检测膀胱癌的风险...
- 【佳学基因检测】肺癌的风险遗传基因检测...
- 【佳学基因检测】视网膜母细胞瘤基因检测概述...
- 【佳学基因检测】视网膜母细胞瘤基因检测机构介绍_北京...
- 【佳学基因检测】颚骨骨化纤维瘤基因检测机构介绍...
- 【佳学基因检测】多发性软骨瘤病基因检测机构介绍...
- 【佳学基因检测】外耳道异位症基因检测机构介绍...
- 【佳学基因检测】径向干骺端外生骨疣基因检测机构介绍...
- 【佳学基因检测】桡骨外生骨疣( Exostoses of the radius)基因检测机构介绍...
- 【佳学基因检测】尺骨的畸形基因检测机构介绍...
- 【佳学基因检测】前臂骨骼的异常基因检测机构介绍...
- 【佳学基因检测】肩胛骨外生骨疣( Scapular exostoses)基因检测机构介绍...
- 【佳学基因检测】肋骨外生骨疣(Rib exostoses)基因检测机构介绍...
- 【佳学基因检测】外生骨疣基因检测机构介绍...
- 【佳学基因检测】骨样骨瘤( Osteoid osteoma)基因检测机构介绍...
- 【佳学基因检测】骨瘤基因检测机构介绍...
- 【佳学基因检测】内生软骨瘤基因检测机构介绍...
- 【佳学基因检测】视神经胶质瘤基因检测机构介绍...
- 【佳学基因检测】胶质瘤基因检测机构介绍...
- 【佳学基因检测】神经上皮肿瘤基因检测机构介绍...
- 【佳学基因检测】神经外胚层肿瘤基因检测机构介绍...
- 【佳学基因检测】神经组织肿瘤基因检测机构介绍...
- 【佳学基因检测】骨肉瘤基因检测机构介绍...
- 【佳学基因检测】先天性神经母细胞瘤基因检测机构介绍...
- 【佳学基因检测】局部神经母细胞瘤( Localized neuroblastoma)基因检测机构介绍...
- 【佳学基因检测】神经母细胞瘤基因检测机构介绍...
- 【佳学基因检测】外周原始神经外胚层肿瘤基因检测机构介绍...
- 【佳学基因检测】室管膜母细胞瘤(Ependymoblastoma)基因检测机构介绍...
- 【佳学基因检测】髓上皮瘤基因检测机构介绍...
- 【佳学基因检测】中央原始神经外胚层肿瘤基因检测机构介绍...
- 来了,就说两句!
-
- 贼新评论 进入详细评论页>>



