【佳学基因检测】药物代谢基因基因检测揭示吸烟和乳腺癌中p53致病基因突变
生活习惯如何影响癌症的发生基因检测导读:
I 期和 II 期酶的多态性可能会增加关键肿瘤抑制基因(如p53 )突变的发生,并通过增加致癌物和/或内源性雌激素的活化或解毒作用来增加乳腺癌风险。基因检测与改变生活习惯预防肿瘤发生特别行动小组分析了 323 个乳腺肿瘤样本中CYP1B1、GSTM1、GSTT1和GSTP1和p53突变的多态性。大约 11% 的患者表现出p53突变。具有突变的女性的诊断发病年龄明显更小(P = 0.01),并且被归类为 II 期或更高阶段的肿瘤发生率更高(P= 0.002)。与没有突变的女性(39%)相比,更多有突变的女性(55%)有吸烟史。尽管没有一种基因型单独与 p53 突变相关,但阳性吸烟史与GSTM1无效等位基因女性的p53突变相关[OR = 3.54; 95% CI = 0.97–12.90 P = 0.06] 与具有野生型基因型和吸烟史的女性相比 [OR = 0.62, 95% CI = 0.19–2.07],尽管这种关联没有达到统计学意义。为了测试基因-基因相互作用,基因检测与改变生活习惯预防肿瘤发生特别行动小组在高加索病例中的探索性分析表明,具有组合GSTP1 105 VV、CYP1B1 432 LV/VV 和GSTM1的个体阳性基因型更可能携带p53突变[OR = 4.94; 95% CI = 1.11–22.06]。基因检测与改变生活习惯预防肿瘤发生特别行动小组的研究结果表明,基因-吸烟和基因-基因相互作用可能会影响乳腺肿瘤中p53突变的患病率。阐明由于常见基因多态性和吸烟的遗传毒性作用导致的乳腺癌病因学,将使基因检测与改变生活习惯预防肿瘤发生特别行动小组能够改进遗传易感亚群中预防策略的设计,例如生活方式的改变。
生活习惯如何影响癌症的发生基因检测关键词:
乳腺癌,p53,多态性,药物代谢,基因突变,基因变异,基因检测
吸烟是如何影响女性妇科肿瘤的发生的:基因检测找原因
乳腺癌是美国女性癌症相关死亡的第二大原因 。一些已知的乳腺癌危险因素包括既往活检、放射治疗、家族史和生殖史,但这些因素可能仅占诊断乳腺癌病例的一半 。虽然决定乳腺癌发病率的病因因素尚未完全确定,但很明显,环境和遗传因素都在乳腺癌发生中起作用。
体外和体内动物研究提供的证据表明,暴露于环境污染物和/或内源性雌激素可能导致乳腺癌的发展 。李等人。 证明,与无癌症对照人群相比,在乳腺癌病例的正常邻近组织中发现芳香族 DNA 加合物的频率更高,这支持了环境污染物对乳腺癌风险的贡献。吸烟对乳腺癌的贡献是一个有争议的领域,因为吸烟具有潜在的抗雌激素作用 。然而,对有关吸烟和乳腺癌的文献的回顾表明,吸烟不太可能具有保护作用 。最近的一项队列研究支持吸烟与乳腺癌的关联 ,而卡罗来纳州乳腺癌研究发现当前吸烟者的p53突变比非吸烟者更频繁 。
潜在的乳腺癌致癌物不仅限于外源性化合物;内源性雌激素也可能是乳腺癌发生的一个因素。一些已知的风险因素与整个生命周期中的雌激素暴露有关,例如初潮早或绝经晚,以及肥胖 ,这与卵巢外雌激素的产生有关 。雌激素可刺激细胞增殖 并在代谢为儿茶酚雌激素和 3,4-羟基儿茶酚雌激素醌 (CE-3,4-Q) 后诱导 DNA 损伤,后者可形成脱嘌呤加合物并产生活性氧 。
外源性和内源性化学物质都需要通过 I 期细胞色素 P450 (CYP450) 酶进行代谢激活,以引起 DNA 损伤。如果在 I 期代谢过程中产生的反应性代谢物没有被 II 期酶解毒,例如谷胱甘肽 S-转移酶 (GST),则可能会发生永久性遗传损伤。这表明个体代谢外源性和内源性致癌物质的能力可能会影响他们患乳腺癌的风险。
CYP1B1 在正常和癌变乳腺组织中均有表达 ,并且能够激活广泛的潜在致癌底物,包括多环芳烃 和雌激素 。CYP1B1 对雌激素的 4-羟基化似乎是主要的羟基化途径,并导致形成潜在的致癌儿茶酚雌激素代谢物 。外显子 2 ( A119S ) 和外显子 3 ( L432V )中的单核苷酸多态性 (SNP)已被证明会改变酶的代谢能力 。有人建议 432 V 等位基因增加 CYP1B1 的催化活性 以及产生的 4-OH 与 2-OH 儿茶酚雌激素代谢物的比例 ,尽管其他人发现 SNP 对酶活性没有影响或表明 432 L 等位基因实际上增加了催化活性 。
在 GST 中也发现了多态性。GSTM1和GSTT1在具有各自无效等位基因的个体中都被删除 ,这可能会阻止活化底物的解毒。多环芳烃,例如在香烟烟雾中发现的多环芳烃,是 GSTM1 的已知底物,因此,缺乏这种酶可能是这些致癌物解毒的不利因素 。乳腺组织中的主要 GST ,GSTP1,有两个功能性 SNP,位于密码子 105 和 114,导致 I105V 和 A114V 的氨基酸取代。这些 SNP 会根据被代谢的底物影响酶活性 。虽然 GSTP1 也被认为可以将 GSH 与儿茶酚雌激素醌结合 ,但 SNP 对这种代谢的影响尚未确定。
多项研究分析了这些多态性与乳腺癌风险的关系。一些研究发现,乳腺癌风险与单个基因型或与其他风险因素相互作用时存在关联 ,很少有人分析GSTP1 A114V SNP 。然而,其他研究并未证实这些关联 。这些相互矛盾的结果可能是由于乳腺癌人群中女性的异质性,因为每个患者的乳腺癌可能是不同环境和遗传因素相互作用的结果。很少有人尝试将在关键致癌基因位点观察到的突变发生频率和类型与乳房组织代谢化学致癌物的能力进行比较。在这方面,对日本肺癌人群的研究发现与 SNP(例如CYP1A1基因的 I462V 或Msp I SNP)和肺肿瘤组织中p53突变的发生率有关 。p53基因是一种重要的肿瘤抑制基因 在 15-30% 的乳腺癌病例中发生突变 ,并且与较差的预后和较短的生存时间有关 。在乳腺癌患者中,Nedelcheva Kristensen 等人。 和 Gudmundsdottir 等人。 表明p53基因的突变与 GST 酶的多态性有关。因此,基因检测与改变生活习惯预防肿瘤发生特别行动小组假设在p53中表现出突变的患者更可能天生对环境和内源性产生的毒物敏感,因为它们具有遗传决定的代谢致癌物的能力,这将导致活化的致癌代谢物水平升高。
基因检测与改变生活习惯预防肿瘤发生特别行动小组进行了一项仅限病例的研究,以检验在 I 期酶CYP1B1和 II 期酶GSTM1、GSTT1和GSTP1中具有多态性的女性p53突变风险增加的假设。由于肿瘤抑制基因位点的损伤可能导致预后不良,这些研究可能有助于早期识别关键调控基因改变风险增加的患者亚群,这些基因的产物对乳腺癌的病理生物学产生不利影响。
材料和方法
研究人群
本研究中使用的患者人群与先前研究中描述的人群相似 。乳腺癌病例主要在维克森林大学浸信会医学中心的乳房护理中心招募,部分样本也由摩西 H. Cone 纪念医院和北卡罗来纳大学教堂山分校 Lineberger 综合癌症中心提供,来自正在进行的研究于 1998 年 11 月至 2004 年 5 月进行。研究对象至少 18 岁,能够说英语并理解知情同意,并且以前没有癌症病史。每个研究对象都获得了研究方案的详细描述,并签署了经每个机构的机构审查委员会批准的知情同意书。从所有研究对象中采集 20 ml 血液样本以及一份包含人口统计信息、已确定的乳腺癌风险因素、病史和家族史。对于每个病例参与者,如果有的话,石蜡包埋的乳腺肿瘤或淋巴结被检索到p53突变分析。
基因分型
DNA,用于对药物代谢酶中的多态性进行基因分型,并作为p53中的匹配对照如制造商的方案中所述,使用 QIAamp® DNA Blood Mini Kit (Qiagen, Valencia, CA) 从每个参与者捐赠的 200 μl 血液样本中分离突变分析。对于缺乏血液样本的乳腺癌病例,从为该患者获得的石蜡包埋肿瘤组织制备的载玻片上的正常组织中提取 DNA。使用由 400 μg/ml 蛋白酶 K、1% Tween-20 和 TE 缓冲液(10 mM Tris-HCl、0.1 mM EDTA)组成的消化缓冲液分离 DNA。对于从 UNC 获得的样本,匹配的 DNA 样本是从从同一患者身上建立的淋巴母细胞系获得的,如前所述 。
GSTM1和GSTT1的基因分型是使用先前描述的多重聚合酶链式反应 (PCR) 技术的修改来确定的 。分析 PCR 产物是否存在 480 bp GSTT1和 231 bp GSTM1 PCR 产物,其中 158 bp GSTM4产物用作内部对照。对于需要使用石蜡包埋组织 (PET) 和一些血液样本的样品,GSTM1引物与之前描述的GSTT1和 β-珠蛋白引物组一起使用(表1),产生GSTM1:231 bp、GSTT1:111 bp 和 β-珠蛋白:268 bp 的 PCR 产物。
表1:基因分型引物、退火温度和 SSCP 条件
|
引物
|
寡核苷酸序列
|
退火 (°C)
|
SSCP凝胶
|
SSCP 缓冲区
|
SSCP 温度。
|
|
GSTMP1
|
5'-CGC CAT CTT GTG CTA CATTGC CCG-3'
|
||||
|
GSTMP2
|
5'-ATC TTC TCC TCT TCT GTC TC-3'
|
||||
|
GSTMP3
|
5'-TTC TGG ATT GTA GCA GAT CA-3'
|
61
|
不适用
|
不适用
|
不适用
|
|
GSTT1-5'
|
5'-TTC CTT ACT GGT CCT CAC ATC TC-3'
|
||||
|
GSTT1-3'
|
5'-TCA CCG GAT CAT GGC CAG CA-3'
|
||||
|
GSTT1(PET)–5′
|
5'-GCC CTG GCT AGT TGC TGA AG-3'
|
||||
|
GSTT1(PET)–3′
|
5'-GCA TCT GAT TTG GGG ACC ACA-3'
|
61.5
|
不适用
|
不适用
|
不适用
|
|
β-珠蛋白-5′
|
5'-CAA CTT CAT CCA CGT TCA CC-3'
|
||||
|
β-珠蛋白-3′
|
5'-GAA GAG CCA AGG ACA GGT AC-3'
|
||||
|
GSTP1X5-5′
|
5'-AAC CCC AGG GCT CTA TGG G-3'
|
55
|
不适用
|
不适用
|
不适用
|
|
GSTP1X5-3′
|
5'-GAA GCC CCT TTC TTT GTT-3'
|
||||
|
GSTP1X6-5′
|
5′-GAG AGT AGG ATG ATA CAT GG-3′
|
55
|
15/24
|
乙
|
13°C
|
|
GSTP1X6-3'
|
5′-GGA ACA GCA TGG GGC CAG ATG-3′
|
||||
|
CYP1B1X2-5'
|
5'-TAC GGC GAC GTT TTC CAG AT-3'
|
61
|
SSCP
|
15/24
|
12°C
|
|
CYP1B1X2-3'
|
5′-CGT GAA GAA GTT GCG CAT CA-3′
|
||||
|
CYP1B1X3–5'
|
5'-ATG CGC TTC TCC AGC TTT GT-3'
|
60
|
15/24
|
15/24
|
10°C
|
|
CYP1B1X3-3'
|
5'-TCA GGT CCT TGT TGA TGA GG-3'
|
GSTP1 I105V SNP的基因分型使用 PCR 确定,然后是限制性片段长度多态性。GSTP1 I105V PCR 产物在含有 20 U Bsm B1 (NE Biolabs, Beverly, MA) 和 1× NE Buffer 3 (100 mM NaCl, 50 mM Tris-HCl, 10 mM MgCl 2 , 1 mM二硫苏糖醇)。分析 PCR 产物的野生型 166 bp 片段或变体 94 和 72 bp 片段。CYP1B1 A119S和 L432V 和GSTP1 A114V 基因型使用先前描述的用于 GenePhor 电泳系统的PCR-SSCP 技术 进行分析(条件为表格1)。每个基因/外显子的 PCR 反应混合物相似:2.5 mM MgCl 2,0.2 mM(0.25 mM 用于来自 PET 的GSTM1/T1分析)dNTP 混合物(Promega,Madison,WI),每种引物 0.2 μM,1-2 Ampli Taq Polymerase Gold (Applied Biosystems, Foster City, CA) 或Taq DNA 聚合酶 (Eppendorf, Westbury, NY) 与制造商提供的缓冲混合物和 2 μl 模板 DNA 的 U。
进一步进入研究,在维克森林大学医学院人类基因组学中心的协助下,使用 MALDI-TOF 质谱MASSArray® ( Sequenom® , San Diego, CA) 以及通过在维克森林大学医学院生物分子资源设施 DNA 测序核心或 MWG-Biotech, Inc. (High Point, NC) 的协助下进行测序。
对于用于确定CYP1B1和GST中 SNP 的所有测定,使用含有已知 SNP 的细胞系或组织进行了初步实验,并对所得基因产物进行测序,以验证该测定可以准确测定每个基因/外显子中的单个 SNP .
p53突变分析
从每个 PET 样品上切下多个 5 μm 切片。研究人员与合作的病理学家一起,在对组织样本进行显微切割之前,广泛审查了 H&E 染色的载玻片。LCM 中使用的每张载玻片均使用美国国家环境健康科学研究所 (NIEHS, dir.niehs.nih.gov/dirlep/lcm/protocols.html ) 定义的 H&E 染色程序的修改进行脱蜡和染色) 用于 LCM。然后使用带有 CapSure™ Macro LCM 盖 (Arcturus) 的 PixCell II Microdissection Station (Arcturus, Mountain View, CA) 对脱蜡载玻片进行显微切割。通过在 37°C 的培养箱中用由 400 μg/ml 蛋白酶 K、1% Tween-20 和 TE 缓冲液(10 mM Tris-HCl、0.1 mM乙二胺四乙酸)。过夜消化后,将样品加热至 95°C 8 分钟以使蛋白酶 K 失活。如果有足够的组织可用,则为每个样品收集多个盖子。
消化物的等分试样(5-10 μl)用于扩增肿瘤 DNA 进行两轮p53基因外显子 5-9 的 PCR,使用列出的嵌套引物表 2. 扩增反应混合物由 2.5 mM MgCl 2、0.2 mM dNTP mix (Promega)、正向和反向引物各 0.2 μM、4 U Ampli Taq Polymerase Gold (Applied Biosystems) 或Taq DNA 聚合酶 (Eppendorf) 和制造商提供的缓冲液混合物和 5–10 μl 消化液。在 2(对于 Eppendorf Taq)或 10(Ampli Taq )分钟的初始变性步骤之后,通过 40 个循环的 94°C 变性 30 秒扩增 DNA,然后退火 2 分钟(见表 2温度)和延伸在 72°C。在二次扩增之前,使用 PerfectPrep® PCR Cleanup 96 Kit (Eppendorf) 纯化初级 PCR 产物。循环次数减少到 25 次,二次扩增反应的退火和延伸时间缩短到 1 分钟。使用 5 到 10 微升初级或纯化初级 PCR 产物作为模板进行二级扩增。不需要二次扩增反应的匹配血液样本的扩增利用二次引物组和 40 个循环的 30 秒变性和 1 分钟退火和延伸。
表 2:p53引物和 SSCP 条件
|
外显子
|
底漆
|
寡核苷酸序列
|
长度
|
初级/秒。
退火 (°C) |
凝胶
|
缓冲
|
SSCP
温度 |
|
5
|
3'初级
|
5'-CCC TGT CGT CTC TCC AGC CC-3'
|
58
|
||||
|
5′初级/
二级 |
5′-TTC CTC TTC CTA CAG TAC TC-3′ a
|
212 个基点
|
58
|
15/24
|
15/24
|
20°C
|
|
|
3′二级
|
5′- CCC AGC TGC TCA CCA TCG-3′a
|
||||||
|
6
|
3'初级
|
5'-CTC CCA GAG ACC CCA GTT GC-3'
|
59
|
||||
|
5′初级/
二级 |
5′-CCT CAC TGA TTG CTC TTA GG-3′ a
|
147 bp
|
60
|
15/24
|
15/24
|
15°C
|
|
|
3′二级
|
5'-AGT TGC AAA CCA GAC CTC AG-3' a
|
||||||
|
7
|
5'初级
|
5'-GGC GCA CTG GCC TCA TCT TG-3'
|
65
|
||||
|
5′二级
|
5′-TGT GTT ATC TCC TAG GTT GG-3′a
|
143 bp
|
58
|
15/24
|
乙
|
5°C
|
|
|
3′初级/
二级 |
5′-TGG CAA GTG GCT CCT GAC-3′a
|
||||||
|
5′-测序
|
5'-TAT CTC CTA GGT TGG CTC TG-3'
|
||||||
|
8
|
3'初级
|
5'-CAC CCT TGG TCT CCT CCA CC-3'
|
58
|
||||
|
5′初级/
次级 |
5'-TCC TAT CCT GAG TAG TGG T-3' a
|
166 bp
|
58
|
15/24
|
15/24
|
17°C
|
|
|
3′二级
|
5'-TCC TGC TTG CTT ACC TCG-3' a
|
||||||
|
9
|
5'初级
|
5′-GGT GGA GGA GAC CAA GGG TG-3′
|
65
|
||||
|
3'初级
|
5'-AAC AGT CAA GAA GAA AAC GGC-3'
|
185 bp
|
15/24
|
15/24
|
12°C
|
||
|
5′二级
|
5'-GCA GTT ATG CCT CAG ATT CAC-3'
|
58
|
|||||
|
3′二级
|
5'-GGC ATT TTG AGT GTT AGA CTG-3'
|
||||||
|
3′-测序
|
5′-TGA GTG TTA GAC TGG AAA CTT T-3′
|
a表示引物先前已描述 。
p53 PCR 产物最初使用单链构象多态性 (SSCP) 和 GenePhor 平板电泳系统 (Amersham Biosciences, Piscataway, NJ) 筛选突变。变性产物通过 GenePhor 系统在每个外显子预定的温度下电泳分离,并使用制造商协议中描述的推荐电压和功率。电泳后,根据制造商的方案,用 Plus One DNA Silver Staining Kit (Amersham Biosciences) 对凝胶进行染色。所有表现出条带偏移的肿瘤都被重新放大和重新分析,以确认偏移并消除Taq的可能性- 引发的错误。所有表现出重复带移的肿瘤均由维克森林大学医学院生物分子资源设施 DNA 测序核心或 MWG-Biotech, Inc. 通过对纯化的二级 PCR 产物的直接测序或根据需要通过分离 PCR 进行测序来自 SSCP 凝胶的产物,沉淀,并从洗脱的条带中重新扩增。由于存在杂合插入或缺失而难以解释的样品在使用 TOPO TA® 克隆试剂盒 (Invitrogen, Carlsbad, CA) 克隆 PCR 产物后进行测序。随着更多高通量技术的出现,大约三分之一的 PCR 产物被 SpectruMedix LLC(州立大学,PA) 通过 Reveal™ 温度梯度毛细管电泳 (TGCE) 和 SpectruMedix 使用 SpectruMedix 分析软件分析的样品。至于 SNP 分析,最初的研究是使用从已知细胞系中获得的 DNA 进行的。p53突变或患者样本,以确保检测可以识别突变——在这些情况下,对样本进行测序以确认结果。
统计分析
使用卡方或Fisher精确检验评估具有和不具有p53突变的女性之间的分类人口统计数据的比较。Wilcoxon 秩和检验用于评估连续特征的差异。在调整患者特征(包括年龄、初潮年龄、吸烟史和体重指数(BMI))后,逻辑回归用于估计和评估基因型效应的显着性。最初考虑基因型和效应修饰剂之间的所有双向相互作用,并使用向后逐步算法从模型中去除不显着的相互作用(P> 0.05)。首先排除具有最高 P 值的相互作用,并如所述重复模型。使用统计分析系统(SAS Institute,Cary,NC)完成分析。
为了测试高阶基因-基因相互作用,使用了多元自适应回归样条 (MARS)-logit 模型。MARS-logit 模型 是结合 MARS 和传统逻辑模型的混合模型。模型过拟合,然后删除对模型贡献最小的项。基函数的最大数量用于控制模型在第一步中的大小,最终大小由每个基函数收取的自由度 (df) 决定。在本研究中,10 折交叉验证用于 MARS 模型选择。如果10倍交叉验证选择的模型太小,每个基函数收费三个df。基因检测与改变生活习惯预防肿瘤发生特别行动小组测试了 1、2 和 3 向交互。
在 MARS-logit 混合模型中,MARS 被用作变量筛选工具,并且选择的术语及其扩展术语被插入到逻辑回归模型中,这在 Cook 等人中已有描述。。库克在逻辑模型中使用了向前向后和向后向前自动选择;然而,这项研究先向后使用,然后丢弃无关紧要的变量。BIC(贝叶斯信息标准) 被用作最终模型选择的标准,因为这通过惩罚模型添加变量来阻止模型过度拟合,并且它比 Akaike 信息标准更保守。本研究使用了 SAS 9.1 版(SAS Institute)和商业 MARS 软件(Salford 系统,圣地亚哥,CA)。
生活习惯如何影响癌症的发生基因检测结果
在本研究中分析了p53突变的 323 名(301 名高加索人,22 名非洲裔美国人)女性中,34 名(11%)表现出p53外显子 5-9 的突变,低于先前在乳腺癌中报道的预期 15-30%患者人群 。人群差异可能导致本研究中观察到的频率较低 。其中两名女性有一个以上的突变(#3260 和 #3854),一名女性有一个复杂的突变,由一个核苷酸突变和串联插入组成,总共分析了 36 个突变(见表3)。由于一些女性表现出相同的突变,因此涉及三十个不同的基因座。30个突变中有26个是单核苷酸突变,3个是小缺失,1个是上述复杂突变。在 26 个单核苷酸突变中,19 个是错义突变,4 个是无义突变,3 个是内含子/剪接位点突变。两个前吸烟者和两个现在吸烟者有缺失和复杂的突变。
表3:详细的 p53突变信息
|
实验室编号
|
吸烟状况
|
密码子
|
基础变化
|
突变类型
|
氨基酸
|
|
错义突变 |
|||||
|
3647
|
不适用
|
135
|
G → A
|
转换
|
半胱氨酸 → 酪氨酸
|
|
3725
|
曾经吸过
|
143
|
T → A
|
颠换
|
缬氨酸→ 谷氨酸
|
|
3109
|
绝不
|
147
|
G → A
|
转换
|
瓦尔→ 伊莱
|
|
3260个
|
绝不
|
151
|
C → T
|
转换
|
专业 → 服务
|
|
3351
|
绝不
|
156
|
G → C
|
颠换
|
精氨酸 → 专业
|
|
3050
|
绝不
|
159
|
G → C
|
颠换
|
阿拉→临
|
|
3854乙
|
保有吸烟习惯
|
161
|
C → A
|
颠换
|
阿拉→天冬氨酸
|
|
3039
|
曾经吸过
|
172
|
G → A
|
转换
|
瓦尔→ 伊莱
|
|
5085
|
不适用
|
193
|
C → T
|
转换
|
他的 → 蒂尔
|
|
3663
|
绝不
|
220
|
T → C
|
转换
|
蒂尔→ 他的
|
|
5137
|
绝不
|
234
|
T → A
|
颠换
|
酪氨酸→ 氨基酸
|
|
3001
|
保有吸烟习惯
|
237
|
T → A
|
颠换
|
遇见→赖氨酸
|
|
3682
|
曾经吸过
|
237
|
G → A
|
转换
|
遇见→ 伊莱
|
|
3030
|
曾经吸过
|
248
|
G → T
|
颠换
|
精氨酸 → 亮氨酸
|
|
3038
|
曾经吸过
|
248
|
C → T
|
转换
|
精氨酸 → 色氨酸
|
|
3058
|
绝不
|
248
|
C → T
|
转换
|
精氨酸 → 色氨酸
|
|
3092
|
绝不
|
248
|
C → T
|
转换
|
精氨酸 → Gln
|
|
3232
|
绝不
|
248
|
G → A
|
转换
|
精氨酸 → Gln
|
|
3464
|
绝不
|
248
|
G → A
|
转换
|
精氨酸 → Gln
|
|
3260个
|
绝不
|
248
|
G → A
|
转换
|
精氨酸 → Gln
|
|
5262
|
绝不
|
248
|
G → A
|
转换
|
精氨酸 → 色氨酸
|
|
3975
|
保有吸烟习惯
|
266
|
G → C
|
颠换
|
甘氨酸 → 精氨酸
|
|
3594
|
保有吸烟习惯
|
273
|
G → A
|
转换
|
精氨酸 → 他的
|
|
5110
|
曾经吸过
|
273
|
G → A
|
转换
|
精氨酸 → 色氨酸
|
|
3660
|
绝不
|
282
|
C → T
|
转换
|
精氨酸 → 他的
|
|
无意义突变 |
|||||
|
3070
|
曾经吸过
|
192
|
C → T
|
转换
|
Gln → 停止
|
|
3764
|
曾经吸过
|
196
|
C → T
|
转换
|
精氨酸 → 停止
|
|
5053
|
绝不
|
204
|
G → T
|
颠换
|
Glu → 停止
|
|
3151
|
绝不
|
213
|
C → T
|
转换
|
精氨酸 → 停止
|
|
剪接位点突变 |
|||||
|
3091
|
绝不
|
N14679 2 bp 5′
|
A → C
|
颠换
|
不适用
|
|
3854乙
|
保有吸烟习惯
|
N14680 1 bp 5′
|
G → A
|
转换
|
不适用
|
|
3645
|
曾经吸过
|
N14755 1 bp 3'
|
G → T
|
颠换
|
不适用
|
|
实验室编号
|
吸烟状况
|
密码子
|
编码顺序
|
删除的
序列 |
del/Ins。根据
|
|
缺失和复杂突变 |
|||||
|
5142
|
曾经吸过
|
229
|
GAC TGT ACC
|
GAC
|
GT
|
|
5126
|
曾经吸过
|
245
|
GGC GGC ATG
|
GGC GCA TG
|
G
|
|
3632
|
保有吸烟习惯
|
253–254
|
ACC ATC ATC
|
ACC ATC ATC
|
CAT
|
|
3610
|
保有吸烟习惯
|
327–328
|
TAT TTC
|
TAA ATT C
|
A
|
a,b表示来自同一患者的突变。
这些突变可能会影响蛋白质功能。三个缺失和复合突变将导致移码(2 个样本)、在密码子 253 和 254 之间发现的三个碱基对缺失(1 个样本)(导致一个氨基酸的丢失),或者如复合物中所见突变(1 个样本)引入终止密码子,然后进行移码。预计这四种无义突变会产生截短的蛋白质。其中三名女性在潜在的内含子剪接位点发生突变;这些突变的功能意义尚不清楚。
错义突变是发现的主要单核苷酸突变,与国际癌症研究机构 (IARC) 数据库中报告的结果一致 。在该人群中发现的最常见的突变类型是 G:C → A:T,这也与 IARC 数据库中确定的最常见的乳腺癌突变类型一致 。错义突变由 16 个不同密码子的 19 个不同氨基酸取代组成。在密码子 237 处发生了两种不同的突变,在密码子 248 处发现了三种不同的突变。本研究中的八名女性在密码子 248 处发生了突变,这是乳腺癌中已知的突变热点 。IARC 数据库中包含的信息表明,其中一些错义突变在蛋白质功能方面具有功能意义 。
将 34 名p53突变女性与无突变女性的特征进行比较时,诊断年龄和疾病分期显着不同(分别为P = 0.01 和 0.002,表 4)。与没有突变的女性相比,有突变的女性的诊断年龄明显更小[野生型的中位年龄 = 59.9,突变型的中位年龄 = 50.0],并且更有可能患有 II-IV 期疾病(66.7% 与39.0%)。吸烟状态(曾经/从不)与p53状态之间的关联具有临界统计学意义(P = 0.08),因为具有p53突变的女性往往有吸烟史。然而,p53突变状态并没有因种族、BMI、家族史、当前吸烟状况、初潮年龄、产次、儿童数量或首次活产年龄而异。
表 4:p53个人特征突变
|
多变的
|
类别
|
野生型 (N = 289)
|
突变体(N = 34)
|
P值
|
|
种族
|
白种人
|
269 (93%)
|
32 (94%)
|
1
|
|
非裔美国人
|
20 (7%)
|
2 (6%)
|
||
|
年龄
|
平均值 (SD)
|
59.55 (12.51)
|
53.66 (13.16)
|
0.01 *
|
|
中位数(范围)
|
59.90 (27.87–49.88)
|
49.95 (31.90–84.38)
|
||
|
失踪
|
0
|
0
|
||
|
家史
|
不 (%)
|
209 (77%)
|
25 (78%)
|
0.9
|
|
母亲/姐妹 (%)
|
62 (23%)
|
7 (22%)
|
||
|
失踪
|
18
|
2
|
||
|
初潮年龄
|
≤12
|
136 (45.9%)
|
10 (13.3%)
|
0.11
|
|
13-14
|
12 (36.4%)
|
16 (48.5%)
|
||
|
15+
|
39 (14.2%)
|
7 (21.2%)
|
||
|
失踪
|
17
|
1
|
||
|
吸烟史
|
绝不 (%)
|
169 (61%)
|
15 (45%)
|
0.08
|
|
曾经 (%)
|
107 (39%)
|
18 (55%)
|
||
|
失踪
|
13
|
1
|
||
|
当前吸烟者
|
不 (%)
|
236 (88%)
|
26 (81%)
|
0.28
|
|
是的 (%)
|
33 (12%)
|
6 (19%)
|
||
|
失踪
|
20
|
2
|
||
|
体重指数
|
平均值 (SD)
|
27.61 (6.11)
|
25.71 (4.23)
|
0.18
|
|
中位数(范围)
|
26.26 (16.97–58.39)
|
25.36 (18.72–36.04)
|
||
|
失踪
|
18
|
3
|
||
|
儿童数量
|
平均值 (SD)
|
2.15 (1.43)
|
2.03 (1.47)
|
0.56
|
|
中位数(范围)
|
2 (0–9)
|
2 (0–6)
|
||
|
失踪
|
12
|
1
|
||
|
平价
|
未生育 (%)
|
36 (13%)
|
5 (15%)
|
0.78
|
|
≥1 名儿童 (%)
|
241 (87%)
|
28 (85%)
|
||
|
失踪
|
12
|
1
|
||
|
肿瘤阶段a
|
0-我
|
175 (61.0%)
|
11 (33.3%)
|
0.002 *
|
|
二至四
|
112 (39.0%)
|
22 (66.7%)
|
||
|
失踪
|
5
|
1
|
||
|
首次活产年龄
|
平均值 (SD)
|
23.38 (4.73)
|
25.18 (6.17)
|
0.17
|
|
中位数(范围)
|
23 (15.00–41.00)
|
25 (15.00–39.00)
|
||
|
失踪
|
15
|
1
|
a根据 AJCC 乳腺肿瘤分期指南。
* P<0.05 时具有统计学意义。
评估了四种 I/II 期酶的多态性与p53突变之间的关联。单变量分析发现p53突变状态与GSTM1或GSTT1无效基因型之间没有关联(补充表 1)。粗略的 OR 分析显示p53突变与 GSTP1 105 VV 基因型之间存在微弱但不显着的关联 [OR = 1.47; 95%CI = 0.48–4.51]。与 AA 基因型相比,GSTP1 114 AV 基因型似乎具有一定的保护性 [OR = 0.24; 95% CI = 0.05–1.18]。本研究中的女性都不是GSTP1的纯合子114 VV 等位基因,消除了当两个等位基因都是变异时分析影响的可能性。CYP1B1 A119S 或 L432V 基因型对p53突变状态没有影响。多变量模型揭示了GSTM1与吸烟史(P = 0.023)之间以及GSTP1 I105V 与初潮年龄之间(P = 0.030)之间的显着相互作用。
如图所示表 5与从不吸烟者 (8.1%) 相比,在前吸烟者 (12.9%) 或当前吸烟者 (15.4%) 的乳腺肿瘤中观察到p53突变的发生率略高。一般而言,吸烟与较高但不显着的p53突变患病率相关[前吸烟者的 OR = 2.14, 95%CI = 0.82–5.57,当前吸烟者的 OR = 1.09, 95%CI = 0.35–3.24]。目前的吸烟状况与p53颠换突变的发生率较高有关[OR = 2.34, 95% = 0.46–11.85]。此外,吸烟增加了 GSTM1 无效基因型女性携带p53突变的几率 [OR = 3.81;95% CI = 1.03–14.12] 与GSTM1女性相比阳性基因型 [OR = 0.56; 95% CI = 0.17–1.80]。当这些结果根据阶段进行调整时,几率仍然增加,但交互作用仅略微显着 [OR = 3.54;95% CI = 0.97–12.90, P = 0.06] (表 6)。其他多态性没有通过吸烟状况详细分析,因为没有显着的相互作用。在具有至少一个GSTP1 105 I 等位基因 (II/IV)的女性中,随着初潮年龄的增加,发生p53突变的风险增加 [OR = 1.67;95% CI = 1.24–2.24, P = 0.001] 而在具有GSTP1 105 VV 基因型的女性中,风险随着初潮年龄的增加而降低[OR = 0.11; 95% CI = 0.01–1.06,P = 0.056]。
表 5:吸烟状况与p53突变之间的关联
|
#突变/#
|
粗或
|
调整或
|
||
|
吸烟状况
|
肿瘤
|
%
|
(95% 置信区间)
|
(95% 置信区间)
|
|
任何 p53 突变
|
||||
|
绝不
|
15/185
|
8.1
|
参考
|
参考
|
|
曾经吸过
|
11/85
|
12.9
|
1.69 (0.74–3.84)
|
2.14 (0.82–5.57)
|
|
保有吸烟习惯
|
6/39
|
15.4
|
2.06 (0.75–5.70)
|
1.09 (0.35–3.24)
|
|
转换
|
||||
|
绝不
|
10/185
|
5.4
|
参考
|
参考
|
|
曾经吸过
|
6/85
|
7.1
|
1.33 (0.47–3.79)
|
1.90 (0.59–6.13)
|
|
保有吸烟习惯
|
2/39
|
5.1
|
0.95 (0.20–4.50)
|
0.40 (0.07–2.21)
|
|
颠换
|
||||
|
绝不
|
5/185
|
2.7
|
参考
|
参考
|
|
曾经吸过
|
3/85
|
3.5
|
1.32 (0.31–5.64)
|
1.01 (0.17–5.87)
|
|
保有吸烟习惯
|
3/39
|
7.7
|
3.00 (0.69–13.12)
|
2.34 (0.46–11.85)
|
a根据年龄、初潮年龄、BMI 和肿瘤分期进行了调整。
表 6:p53突变中吸烟史与GSTM1基因型之间的相互作用
|
抽烟
|
p53野生型
|
p53突变体
|
调整或
|
|
|
GSTM1
|
地位
|
n (%)
|
n (%)
|
( 95%CI)
|
|
野生型
|
非吸烟者
|
80 (59.3)
|
10 (58.8)
|
参考
|
|
吸烟者
|
55 (40.7)
|
7 (41.2)
|
0.62 (0.19–2.07)
|
|
|
无效的
|
非吸烟者
|
90 (62.5)
|
5(31.3)
|
参考
|
|
吸烟者
|
54 (37.5)
|
11 (68.7)
|
3.54 (0.97–12.90)
|
a根据年龄、初潮年龄、BMI 和肿瘤分期进行了调整。
检查个体基因型并没有产生与p53突变的统计学显着关联。图1使用 MARS-logit 技术对基因-基因相互作用对突变的影响进行了探索性分析。在这项试点研究中,基因检测与改变生活习惯预防肿瘤发生特别行动小组只使用了来自白种人的数据,因为当包含来自非裔美国人的数据时,显着的相互作用消失了。这些结果表明GSTP1 105 VV、CYP1B1 432 LV/VV 和GSTM1阳性基因型的组合基因型与p53突变相关[OR = 4.94; 95% CI = 1.11–22.06] 与具有其他基因型模式的女性相比。由于样本量很小,有必要在更大的研究中确认这些相互作用,但它支持在确定多态性对突变的影响时检查基因型组合的重要性。
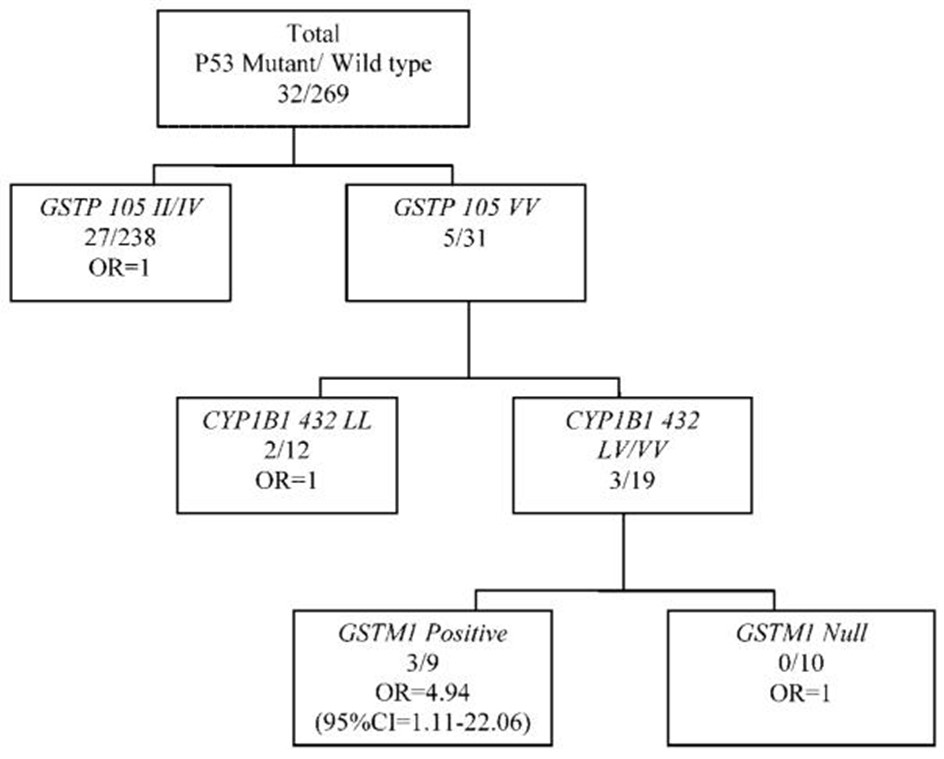
图1:基因-基因相互作用和p53突变。结合基因型和p53突变的探索性分析。报告的优势比根据年龄、初潮年龄、BMI 和吸烟状况进行了调整。
基因检测如何揭示生活习惯与癌症发生的影响的分析与共识
由于诊断出的所有乳腺癌病例中有近一半的病因不明,因此确定与散发性乳腺癌病因有关的遗传风险因素非常重要。分析 I 期和 II 期酶的单个 SNP 与乳腺癌风险之间的关联的多个病例/对照研究提供了相互矛盾的结果 。因此,基因检测与改变生活习惯预防肿瘤发生特别行动小组利用p53基因位点的突变作为易受遗传损伤的患者的生物标志物,这些患者可能更可能表现出药物代谢酶多态性与乳腺癌风险之间的关联。在这项研究中,分析了外显子 5-9 的突变,因为该区域包含在人类癌症中最常发生突变的 DNA 结合域 。
p53突变的女性比没有突变的女性表现出更年轻的诊断年龄。年龄是乳腺癌的一个重要风险因素,因为随着女性年龄的增长,这种风险会增加 。有趣的是,诊断时年龄越小预后越差。因此,基因检测与改变生活习惯预防肿瘤发生特别行动小组的结果表明p53突变的女性诊断年龄较小,这表明致癌基因座突变的遗传易感性可能导致这一易感女性亚群的肿瘤发病较早。在这方面,Sidoni 等人。 表明p53的表达在年轻人群中更为频繁,尽管对巴西乳腺癌病例人群中的p53突变并未证实有和没有突变的女性之间的年龄差异 。这些不同的结果可能是因为两个研究人群之间的环境暴露或遗传因素不同。具有突变的女性也表现出更高阶段的疾病,这已在其他研究中观察到 。Carey 等人最近的一项研究。在更具侵袭性的乳腺癌亚型中证明了p53突变的统计学显着差异。p53的发病率增加就生存和预后而言,年轻女性的突变与更具侵袭性的疾病和较差的结果一致。
这项研究的结果表明,吸烟可能导致p53突变的患病率更高(P = 0.08),这与一项研究表明,PAH 加合物在乳腺癌病例中比对照组更常见 。如前所述,卡罗来纳州乳腺癌研究确定,与从不吸烟者相比,目前吸烟者的乳腺组织中的突变频率明显更高(P = 0.02)。这表明,尽管单独吸烟可能与乳腺癌风险没有直接关系,但它可能与诱导肿瘤抑制基因突变有关,这可能导致更侵袭性的疾病形式。虽然基因检测与改变生活习惯预防肿瘤发生特别行动小组没有发现p53突变状态的GSTM1无效基因型[OR = 0.90; 95% CI = 0.44–1.84],基因检测与改变生活习惯预防肿瘤发生特别行动小组的结果表明,GSTM1无效等位基因与吸烟女性p53突变的增加有关,尽管在调整阶段后显着性是微不足道的。这可能是因为具有突变的样本数量很少。GSTM1 与 I 期代谢过程中产生的反应性亲电子化合物结合,因此预计该基因的缺失会减少香烟烟雾中发现的致癌代谢物的解毒作用。先前的研究支持GSTM1无效等位基因与 DNA 损伤的关联,因为与对照组相比,这些等位基因与癌症病例中的 PAH 加合物有关。与这项研究一致,已注意到GSTM1无效等位基因和吸烟之间的显着相互作用以及它们与乳腺癌病例正常相邻组织中的 DNA 加合物的关联 。饮酒也有类似的相互作用,这支持了基因-环境相互作用和使用遗传标记的重要性 。
基因检测与改变生活习惯预防肿瘤发生特别行动小组基于p53基因位点的遗传损伤对个体 SNP 和乳腺癌风险的分析并未证明与所分析的任何药物代谢多态性有显着关联。然而,Nedelcheva Kristensen 等人之前的一项研究。 证明了GSTP1 105 IV/VV 基因型与p53突变之间的关联(P = 0.055)。Gudmundsdottir 等人。 还注意到 105 VV 基因型和p53突变(P = 0.19)的一个不显着但有趣的趋势和GSTT1频率的统计显着增加p53突变的乳腺癌患者中的无效等位基因(P = 0.019)。这些研究与目前的研究之间的差异可能归因于人群的差异,因为与基因检测与改变生活习惯预防肿瘤发生特别行动小组的北卡罗来纳州人群相比,这些患者是在挪威 和冰岛 招募的。生活方式的差异可能导致环境暴露的差异。之前的研究都没有报告人口统计信息,也没有对潜在的混杂因素和影响修正因素进行调整。事实上,其他研究表明,在p53中发现的突变类型往往在地理上有所不同 ,这表明暴露于环境因子的差异可能会影响多态性对突变产生的影响。
由于样本量有限,基因检测与改变生活习惯预防肿瘤发生特别行动小组的结果表明药物代谢酶中的个体遗传多态性可能不会影响乳腺癌患者的p53突变状态。然而,基因检测与改变生活习惯预防肿瘤发生特别行动小组证明了GSTM1基因型和吸烟之间存在轻微显着的相互作用,这些相互作用会影响p53突变的流行。此外,GSTP1 105 VV、CYP1B1 432 LV/VV 和GSTM1野生型的组合基因型在白种人女性中表现出p53突变的风险几乎增加了 5 倍。CYP1B1 _432 Leu 等位基因与较低水平的 B[a]P 诱导的 DNA 加合物相关,支持多态性对致癌物诱导的 DNA 损伤的影响 。MARS-logit 模型中GSTM1野生型等位基因与乳腺癌风险的关联似乎与吸烟数据和GSTM1对有毒代谢物解毒能力的结果相反。GSTP1是在乳腺组织中发现的最普遍的 GST ,由于 GST 对特定底物的特异性,GSTM1的存在可能会抑制GSTP1的能力由于谷胱甘肽耗尽而对特定的外源物质进行解毒。这是在先前的病例/对照研究中提出的,该研究发现纯合野生型等位基因与乳腺癌之间存在关联 。或者,GSTM1 还能够从某些底物形成更多有毒化合物,而不是对它们进行解毒 。没有分析吸烟对基因-基因相互作用的影响,因为患者数量太少而无法按吸烟状况进行分层。就吸烟者而言,大量接触有毒化学物质可能会压倒正常的解毒途径,而GSTM1以后会起到更多的保护作用。需要利用动物模型和细胞培养系统进行进一步研究,以确定吸烟和不吸烟患者的解毒机制。
基因检测与改变生活习惯预防肿瘤发生特别行动小组的研究结果表明,未来的研究应关注基因-基因和基因-环境相互作用对p53突变诱导的综合影响,这将对基因检测与改变生活习惯预防肿瘤发生特别行动小组对遗传学和基因-暴露相互作用在乳腺肿瘤进展中的理解产生重大影响。随着高通量基因分型方法的快速发展,基因检测与改变生活习惯预防肿瘤发生特别行动小组处于将遗传易感性信息快速转化为健康行为促进的绝佳位置,因为遗传易感亚群更有动力参与行为干预,例如戒烟。
Mol Carcinog:
. 2008 Feb;47(2):88-99. doi: 10.1002/mc.20365.
Polymorphisms in drug metabolism genes, smoking, and p53 mutations in breast cancer
Beth O Van Emburgh 1, Jennifer J Hu, Edward A Levine, Libyadda J Mosley, L Douglas Case, Hui-Yi Lin, Sommer N Knight, Nancy D Perrier, Peter Rubin, Gary B Sherrill, Cindy S Shaw, Lisa A Carey, Lynda R Sawyer, Glenn O Allen, Clara Milikowski, Mark C Willingham, Mark Steven Miller
- 上一篇:【佳学基因检测】胆囊癌基因组学基因检测:生物标志物驱动的临床药物选择
- 下一篇:【佳学基因检测】基因检测发现中药中3',4',5'-三甲氧基黄酮醇(一种槲皮素类似物)的临床前大肠癌化学预防功效和 p53 调节活性:中药治肿瘤的科学依据
- 【佳学基因检测】介绍一个基因检测明确其中一种类型的乳腺癌风险...
- 【佳学基因检测】视网膜母细胞瘤基因测试...
- 【佳学基因检测】视网膜母细胞瘤基因检测机构TOP10...
- 【佳学基因检测】基因检测如何揭示视网膜母细胞瘤与基因突变的关系?...
- 【佳学基因检测】皮肤淋巴细胞瘤基因检测...
- 【佳学基因检测】毛囊周围纤维瘤(Perifollicular fibroma)基因检测...
- 【佳学基因检测】巩膜神经鞘瘤基因检测...
- 【佳学基因检测】皮肤平滑肌瘤基因检测...
- 【佳学基因检测】黏液皮下肿瘤基因检测...
- 【佳学基因检测】皮脂腺癌基因检测...
- 【佳学基因检测】生殖泌尿道的肿瘤基因检测...
- 【佳学基因检测】毛发瘤基因检测...
- 【佳学基因检测】圆柱瘤基因检测...
- 【佳学基因检测】毛母质瘤基因检测...
- 【佳学基因检测】滤泡漏斗肿瘤基因检测...
- 【佳学基因检测】汗孔瘤基因检测...
- 【佳学基因检测】大汗腺汗腺瘤基因检测...
- 【佳学基因检测】毛囊肿瘤基因检测...
- 【佳学基因检测】毛发上皮瘤基因检测...
- 【佳学基因检测】外毛根鞘瘤基因检测...
- 【佳学基因检测】单一三叉神经瘤基因检测...
- 【佳学基因检测】多发性毛囊鞘瘤( Multiple trichilemmomata)基因检测...
- 【佳学基因检测】生殖器肿瘤基因检测...
- 【佳学基因检测】角化棘皮瘤基因检测...
- 【佳学基因检测】皮肤黑色素瘤基因检测...
- 【佳学基因检测】皮肤肥大细胞增多症基因检测...
- 【佳学基因检测】多种皮肤恶性肿瘤基因检测...
- 【佳学基因检测】皮肤平滑肌肉瘤基因检测...
- 【佳学基因检测】棘皮瘤基因检测...
- 【佳学基因检测】皮肤附属肿瘤基因检测...
- 来了,就说两句!
-
- 最新评论 进入详细评论页>>



