【佳学基因检测】睾丸生殖细胞肿瘤基因检测
尽管睾丸生殖细胞肿瘤(testicular germ cell tumour, TGCT)总体上较为罕见,但它却是年轻男性中最常见的恶性肿瘤,其最高发病率出现在 30–34 岁人群中。TGCT 的两种主要组织学类型包括精原细胞瘤(seminoma)和非精原细胞性生殖细胞肿瘤(non-seminomatous germ cell tumour, NSGCT)。NSGCT 通常比精原细胞瘤更具侵袭性,包括胚胎性癌(embryonal carcinoma, EC)、卵黄囊瘤(yolk sac tumour, YST)、绒毛膜癌(choriocarcinoma)以及畸胎瘤(teratoma)等组织学亚型;且在单个病灶中常可见多种组织学成分共存。与大多数其他癌症不同,睾丸生殖细胞肿瘤 很少仅由体细胞驱动突变引起,而是源于其原始细胞——胎儿生殖细胞——的潜在发育潜能未被正常控制,最终导致其重新编程。
越来越多证据表明,癌症的临床行为及其治疗反应反映了其潜在的肿瘤基因组特征。迄今为止,对睾丸生殖细胞肿瘤的基因组测序研究大多局限于分析蛋白编码序列(外显子组)或基于规模较小的全基因组测序(WGS)队列,因此目前文献中仍缺乏对 TGCT 整体基因组图谱的全面描述。值得注意的是,目前已报道的最大 TGCT WGS 研究仅包含 9 例青春期后(>12 岁)患者。对于包括结构变异在内的关键突变过程及其特征在睾丸生殖细胞肿瘤中的表现亦缺乏深入探讨,对生殖细胞肿瘤演化的理解仍存在巨大空白。
为了推进对睾丸生殖细胞肿瘤 的认识,佳学基因检测分析了来自英格兰 7 个 NHS 基因组医学中心、纳入英格兰基因组(GEL)“十万基因组计划”(100kGP)[GEL v12 数据版本]的 57 名 TGCT 患者的 60 个全基因组测序肿瘤样本。本研究对成人 TGCT 的基因组景观、突变机制及克隆结构进行了系统而深入的分析。
鉴定亚型特异性的驱动突变
使用 IntOGen 流程(整合了七种互补的驱动基因发现算法),肿瘤基因解码在 GEL TGCT 队列中搜索潜在的驱动基因。共有八个基因被发现具有显著的体细胞突变(KIT、KRAS、NRAS、RAC1、SPEN、EP300、KLF4、KMT2C)。与 TCGA 的 TGCT 研究一致,KIT 驱动突变定义了精原细胞瘤(seminoma)的一个亚群(图 2)。KIT 突变主要集中在第 17 外显子,其模式与既往在睾丸精原细胞瘤和颅内生殖细胞瘤中报道的情况相似。仅在一名临床 II 期精原细胞瘤患者中观察到同一癌基因(KIT)受到多重突变。
进一步分析识别出在精原细胞瘤亚型中定义不同亚群的额外驱动基因,包括转录因子 KLF4 和 GTP 酶 RAC1 的功能获得性突变,以及组蛋白乙酰转移酶 EP300 的功能丧失性突变(图 2)。
此外,肿瘤基因解码使用三种互补算法(OncodriveFML、OncodriveCLUSTL和 ActiveDriverWGS)搜索非编码区驱动因素。然而,并未发现任何处于正选择压力下的显著非编码元素。
为了补充对 GEL 肿瘤的分析,肿瘤基因解码重新分析了 TGCT 的 TCGA(128 个样本)和 Memorial Sloan Kettering - Metastatic Events and Tropisms(MSK-MET)研究(128 个样本)的数据,以鉴定更多亚型特异性的编码驱动突变。在 TCGA 数据集中,10 个基因的体细胞突变达到了显著性,包括 NOTCH1、PIK3CA、BIRC6、ARID1B 和 LRP1B。在 NSGCT 亚型中还鉴定出两个候选驱动基因 PTMA 和 FAT4,它们主要呈现功能丧失性突变。GEL 队列数据也支持 PTMA(prothymosin alpha)作为候选驱动基因的潜在作用,尽管其先前已在 TGCT 中被提示与肿瘤发生相关,但当前尚未被纳入 COSMIC 癌基因目录。
最后,肿瘤基因解码参考 OncoKB 知识库(http://oncokb.org/)评估了已鉴定驱动基因突变的临床可操作性。结果显示,在 OncoKB 注释的 110 个变异中,有 17%(19/110)具有可靶向性(OncoKB Level 1–4)。其中大多数(18/19)为 Level 3B,即在其他肿瘤类型中已被视为标准治疗依据的预测性生物标志物。
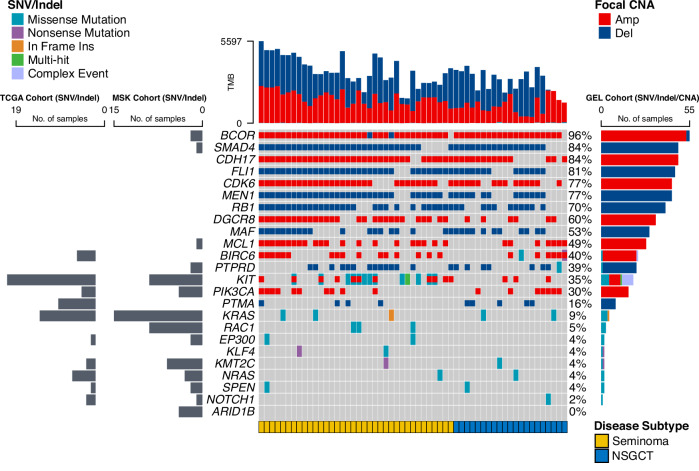
共分析了 57 例成年参与者的样本。独立在癌症基因组图谱(TCGA)和英格兰基因组(GEL)TGCT 队列中鉴定的点突变和插入/缺失(indel)驱动基因,与注释的 GISTIC2 局灶拷贝数变化(focal segments)共同展示。图中还显示了在 Memorial Sloan Kettering—Metastatic Events and Tropisms(MSK-MET)TGCT 队列中这些驱动基因的存在或缺失情况。
在该队列中共发现 17 个重复发生突变的基因,其中 KIT 是最常发生改变的基因(补充数据 2)。颜色编码指示了突变类型或 TGCT 的亚型(见图例)。在同一个基因中出现多于一种突变类型(错义、无义或框内插入)的样本被归类为“多重打击(Multi Hit)”事件。在同一基因中同时检测到驱动突变与扩增/缺失的样本则以两种颜色重叠显示。
Amp 表示扩增(amplification),Del 表示缺失(deletion),CNA 表示拷贝数改变(copy number alteration),NSGCT 表示非精原细胞性生殖细胞肿瘤。
局灶基因组改变中的癌症驱动基因
我们使用 Battenberg 算法估计整个队列的克隆性和亚克隆性拷贝数变异(CNV)。将 GISTIC2 应用于这些拷贝数谱,我们共识别出 29 个在局灶扩增或缺失中反复受影响的基因组区域。
除了既往确立的复发性拷贝数改变(CNA)之外,包括
-
覆盖 KRAS (12p) 的染色体臂级别增益,
-
涉及 KIT 的扩增 (4q12;19% 病例) 和 MDS2 的扩增 (1p36.32;17% 病例),
-
覆盖 DMRT1 (9p24.3;37% 病例) 的缺失(与 TGCT 易感性相关),
我们还鉴定出 26 个新增的事件。
尽管 KIT 突变似乎仅限于精原细胞瘤(seminoma)的一个亚群,但覆盖 KIT 的扩增在 NSGCT 中也有观察到(图 2)。
我们发现以下区域发生了复发性扩增:
-
1q21.3(14%),覆盖癌基因 SETDB1;
-
7q11.23(46%),覆盖 CDK6;
-
22q11.1(25%),覆盖 DGCR8。
在精原细胞瘤中,还观察到局灶缺失涉及 CCNA1(cyclin A1) 和 转录因子 FOXO1(13q13.3),二者均对成功的精子发生至关重要。
值得注意的是,覆盖 AFP(4q13.2) 的局灶扩增也仅出现在一部分精原细胞瘤中(8/57)。虽然甲胎蛋白一般作为与 NSGCT 相关的血清肿瘤标志物,但已有报道指出部分组织学上纯的精原细胞瘤也会出现 AFP 升高。
多个复发性缺失涉及 WNT 信号通路相关基因,包括钙黏蛋白 CDH1 与 CDH11、CREBBP(16q24.2)和 SMAD4(18q22.2)。
互斥性分析显示主要驱动事件大多不会同步出现;然而,我们识别出的最显著驱动基因相互作用为协同事件,包括
-
PIK3CA–MCL1 扩增,
-
RB1–FLI1、RB1–MEN1 和 MAF–SMAD4 缺失(补充图 5)。
互斥事件包括 KIT–MAF 和 PTMA–MCL1。唯一的染色体内配对事件为并存的 MEN1–FLI1 缺失。
12p 增益与 i12p 的结构特征
TGCT 发病的主要体细胞特征是 12p 染色体拷贝数增益,其典型结构为 等臂染色体 i12p。
我们观察到 75%(43/57)肿瘤呈现与至少一个 i12p 一致的等位基因拷贝数模式。其中
-
5/43(12%) 被分类为典型染色体(见补充方法),但具有 12p 臂的复杂重排。
-
这些复杂的 i12p 病例均为精原细胞瘤,且呈现 11q24.3 的复发性局灶缺失,涉及 ETS 转录因子 FLI1。
缺乏 i12p 的肿瘤大多仍为精原细胞瘤(13/14,93%),其特点是 至少拥有 12p 的四个拷贝。
仅在 两个样本中观察到 12q 的杂合性缺失(LOH),提示多数肿瘤在形成 i12p 之前已发生
-
染色体 12 的倍增或
-
第二次全基因组加倍(WGD),
这与先前报道一致。
TGCT 中的结构变异热点
按照 Glodzik 等人描述的方法,我们识别出 1 个涉及大规模串联重复(tandem duplication, TD;>100 kb)的结构变异热点以及 8 个缺失热点。我们在 chr19:55–58 Mb 区域观察到一个 TD 热点,覆盖组蛋白甲基转移酶 GLP。有趣的是,在 C. elegans 中,Notch 受体 glp-1 的功能获得性突变已被报道会导致生殖系肿瘤形成。然而,该热点并未与任何 GISTIC 定义的局灶扩增区域重叠。
与拷贝数缺失相关的缺失热点包括:
-
chr3:60 Mb,覆盖 FHIT(fragile histidine triad) 基因;
-
chr9:7–12 Mb,覆盖蛋白酪氨酸磷酸酶 PTPRD;
-
chr16:78–84 Mb,靶向钙黏素 13(CDH13)。
我们在一个肿瘤(GEL-TGCT-0056)中观察到 染色体碎裂(chromothripsis),这是一个罕见的、具有体细胞型恶性转化的转移性畸胎瘤病例。在该样本中,23 个结构变异在一次灾难性事件中发生,影响染色体 7 和 17,包括 PPM1D 的扩增。该患者中未检测到与 Ewing 肉瘤或相关原始神经外胚层肿瘤(PNET)相关的经典易位或基因融合。
染色体外 DNA(ecDNA)上的 KRAS 扩增
我们进一步利用 GEL 数据集探索睾丸癌中染色体外 DNA(ecDNA)的形成特征。ecDNA 在多种癌症中常与癌基因扩增及预后不良相关。使用 Amplicon Architect 工具,我们在 TGCT 中检测并分类了扩增结构。
在 85%(46/54) 的 TGCT 样本中识别到了扩增子(amplicons)。单区间扩增子的大小范围从 116 kb 到 76 Mb(中位数 4 Mb),超过 85%(113/130) 的扩增子大于 1 Mb。
至少两个样本中观察到的复杂重排覆盖了既往已知 TGCT 癌基因,包括:
-
KRAS、MYC、EGFR,
以及常见致癌通路中的关键基因,如 -
WNT 通路(SOX2)
-
受体酪氨酸激酶(RTK)通路(PDGFRA)
-
p53 通路抑制因子(CDK4/6、MDM2)。
在循环型扩增结构中(其中一例为 ecDNA),唯一被识别出的癌基因为 KRAS,且仅出现在精原细胞瘤(seminoma)中。具有 断裂-融合-桥(breakage-fusion-bridge)机制特征 的扩增子也仅在精原细胞瘤中检测到。
此外,与 NSGCT 相比,精原细胞瘤携带显著更多的扩增结构(p = 0.018)。
完整的突变特征谱(Complete repertoire of mutational signatures)
为了深入理解突变的病因基础,我们提取了突变特征。在大多数肿瘤中,单碱基替换(SBS)主要归属于 SBS5/SBS40 和 SBS1,这些特征被认为源自内源性的、类似时钟的突变过程。然而,只有 SBS5 和 NpCpG 三核苷酸位点上 C>T 的数量与年龄相关(p = 4.3 × 10⁻⁸ 和 p = 0.02)。携带 KIT 突变的精原细胞瘤(seminoma)的 SBS1 明显低于野生型精原细胞瘤(p = 0.0028)以及 NSGCT(p = 5.5 × 10⁻⁶)。
亚型相关的 SBS 模式
某些 TGCT 亚型呈现出独特的 SBS 特征:
-
SBS18(与活性氧 ROS 损伤相关)在两个肿瘤中检测到,这两例均为 NSGCT,且含有少量 YST 成分。
-
在 GEL-TGCT-0038 中,大多数突变均来自 SBS18。
-
该特征此前已在多种儿科癌症、胎盘组织和青春期前/围青春期 YST 患者中被报道。
-
-
SBS35(铂类化疗暴露特征)如预期般在两例化疗后转移灶中检测到。
-
SBS31(另一种铂类药物相关特征)则在一例临床 I 期精原细胞瘤中检测到,该病例在取样后接受了根治性睾丸切除术及卡铂治疗。
-
SBS32(与硫唑嘌呤 azathioprine 治疗相关,且此前未在 TGCT 中报道)检测于 11%(6/57) 的患者中,但这些患者均无此类治疗史。
-
在急性髓系白血病的研究中也发现类似现象,提示除了药物暴露外,可能存在其他导致 SBS32 的突变机制。
-
克隆与亚克隆阶段的特征差异
我们观察到克隆性与亚克隆性突变间的突变特征活性存在差异,总体上亚克隆突变中 SBS5 占比更低(p = 2.2 × 10⁻¹⁶)。
插入/缺失(ID)特征
-
ID 主要由 ID1 和 ID2 构成——二者均与 DNA 复制过程中的滑移有关。
-
由不同 DNA 双链断裂修复机制产生的 ID6 与 ID8 呈互斥现象。
双碱基替换(DBS)特征
在 TGCT 中检测到的 DBS 多数病因不明,例外为:
-
DBS2(吸烟相关),
-
DBS5(铂类化疗相关)。
驱动基因组重排的突变过程
我们进一步探索导致基因组重排的突变过程。
首先,使用一个新的框架对肿瘤的21 种泛癌拷贝数特征(CN1–CN21)进行分型。
结果包括:
-
CN2(四倍体相关)为大多数样本共有,见于精原细胞瘤与 NSGCT。
-
多个肿瘤同时呈现 CN1 与 CN2,提示其呈高倍体或亚四倍体状态。
-
检测到 CN13–CN15 特征,这些特征与特定的数值型染色体不稳定性相关,涉及整臂或整染色体水平的 LOH。
-
CN13(以总拷贝数 1 的 LOH 段为主)仅见于 NSGCT。
-
少部分参与者(3/57,5%)同时携带 CN1、CN13 和 CN15,这些肿瘤具有大量 拷贝数中性 LOH,并出现于转移样本或后续发生转移的原发样本中,提示此特征可能具有临床意义。
结构变异(SV)特征
我们基于类型与大小对结构变异进行分型(方法见正文),并使用与其他突变特征相同的统计框架。检测到 两个结构变异特征(S1、S2),出现在精原细胞瘤与 NSGCT 中。
-
S1 类似参考特征 RefSig R2:以非簇集性易位为特点
-
S2 类似 RefSig R5:以不超过 100 kb 的非簇集性缺失为特点
既往研究中:
-
RefSig R5 与 BRCA2 突变相关
-
RefSig R2 与 TP53 驱动突变相关
虽然本队列未检测到 BRCA2 突变,但在 携带 BRCA2 缺失的肿瘤中 S2 特征显著增加(p = 0.001528,Wilcoxon 检验)。
其他与同源重组修复缺陷相关的特征在本队列中未检出(SBS3)或仅见于少数样本(ID6/ID8)。因此,目前无法明确 BRCA2 缺失是否对整体突变特征谱有贡献。
整合基因组复制的流行率(Prevalence of whole genome duplication)
在睾丸生殖细胞肿瘤(TGCT)中,全基因组复制(WGD)几乎是普遍存在的;近期研究表明这些事件在胚胎发育早期发生。
在本研究的 GEL 队列中,除 1 例外(56/57),所有肿瘤都显示发生了 WGD。
研究团队使用 MutationTimeR 对体细胞突变相对于拷贝数扩增的时间进行了推断,并基于复制前后发生的“时钟式突变”(clock-like mutations)比例来估计 WGD 的时间点。结果显示:
-
中位数约 9 个突变 发生在 WGD 之前(范围 0–375)。
-
在 7 例肿瘤中未观察到任何复制前突变,支持 WGD 极早发生、很可能在宫内期形成(Fig. 3a)。
-
这一现象与大多数实体瘤形成鲜明对比:在其他癌种中,WGD 通常在克隆演化过程中随机出现,而非早期事件(Fig. 3b)。
然而,有三例显示 WGD 相对于其他样本发生得更晚:
-
其中一例为广泛转移、以胚胎癌(EC)成分为主的 GCT,具有估计 375 个 WGD 前突变。
-
另两例均为临床 I 期精原细胞瘤(seminoma),并且均为异时性双侧 TGCT:一名受试者在 100kGP 取样前 30 年第一次确诊,另一名则在取样后 5 年再次确诊。
在这例转移性病例中,既往存在双侧可复性睾丸(retractile testis)的病史,但未记录过双侧 TGCT。近期单细胞研究指出,新生儿睾丸中可存在少量具原始生殖细胞(PGCs)特征的 gonadal 细胞。因此,这些在婴儿期仍残留的 PGC 样细胞可能经历相同的 WGD 过程。
研究进一步利用 PGC 的细胞分裂突变率估计 WGD 在 PGC 发育过程中的发生时点。剔除晚期 WGD 的病例后,TGCT 的中位 WGD 发生于 约第 11 次细胞分裂(范围 0–71.5)。这进一步将 TGCT 的基因组学起点定位于胚胎发育时期。
在发生 WGD 的肿瘤中,75%(42/56)显示同步染色体增益(Fig. 3c),与 PCAWG 中 WGD 肿瘤报告的增益模式整体一致。
另外 21%(12/56)显示非同步(asynchronous)增益,这些肿瘤均为纯精原细胞瘤或以 EC 或 seminoma 成分为主的 NSGCT,提示不同组织发生路径可能具有不同的染色体演化模式。
此外:
-
CN2(四倍体相关拷贝数特征)在同步增益样本中比例更高(P=0.029)。
-
CN14 在非同步增益的基因组中比例更高(P=0.006)。
TGCT 中基因组复制与驱动事件的相对时间关系
研究使用置换方法识别在 TGCT、精原细胞瘤以及 NSGCT 中具有显著富集或缺失的 CNAs,并使用概率模型重建了这些趋异事件的获得顺序,包括 WGD、富集的拷贝数改变,以及候选驱动突变(Fig. 4)。
富集的拷贝数增益事件
涉及多种已知癌基因和 TGCT 驱动基因,例如:
-
MYC(8q11-q24)
-
EGFR(7p11.2)
-
BRAF(7q34)
富集的 LOH(杂合性缺失)事件
涉及多个肿瘤抑制基因,例如:
-
APC(5q22.2)
-
ATM(11q22.3)
-
CDX2(13q12.2)
未发现显著富集的纯合缺失事件。
同时,也鉴定到显著负富集的 CNAs,意味着这些事件可能对 TGCT 无助,或在 WGD 的背景下不适宜发生。
事件顺序
-
与 WGD 发育时间分析一致,四倍化(WGD)是最早事件。
-
随后是 12p 增益,覆盖 KRAS,这可能提示其在成年 TGCT 的肿瘤起始中具有作用。
利用 AmplificationTimeR,研究进一步对染色体 12 的特异性高拷贝增益进行了更精确的时间推断:
-
大多数样本支持 12p 增益在 WGD 之后。
-
但也有部分样本显示 12p 增益发生在 WGD 之前,提示在某些病例中它可能是最早的遗传事件。
组织亚型差异
-
大多数 WGD 后的早期事件是染色体拷贝数增益,并且在 TGCT 中广泛共享。
-
更晚的富集事件则趋向亚型特异:
-
例如 NSGCT 特有的 12q11 增益(覆盖 KIF21A)。
-
-
精原细胞瘤中唯一特异富集的 CNA 是 BRCA2 的 LOH(chr13:18–114 Mb)。
-
虽未达统计学显著,但多数(12/14;86%)属于 年轻发病(<40 岁)。
-
年轻精原细胞瘤中还观察到其他特异富集的 CNAs,例如 chr8:45–129 Mb 和 chr7:60–159 Mb(Fig. 4c)。
克隆结构与驱动突变的时间关系
通过 Dirichlet 过程算法对 SNV 和 indel 按癌细胞比例进行聚类,结果显示:
-
不同患者间 SNV、indel 或 CNA 的亚克隆比例与肿瘤分期或类型无显著关联。
-
一例纯 seminoma 的多部位取样分析显示患者体内肿瘤异质性有限。
在所有亚型中,驱动基因突变(包括 KIT、KRAS、NRAS 等)均为较晚事件,发生在 WGD 之后,并且晚于对应的拷贝数增益或其他 CNA(Fig. 4b, c)。
此外:
-
带有 KRAS 或 KMT2C 驱动突变的患者通常具有更高的诊断年龄。
HLA 丢失在精原细胞瘤中更常见(HLA loss enriched in seminomas)
在 60 例肿瘤中,没有任何样本携带人类白细胞抗原(HLA)基因的非同义突变(方法)。然而,使用 LOHHLA 算法在 6 例肿瘤中检测到 HLA 位点的杂合性缺失(LOH),即父源或母源等位基因的丢失(补充数据 8)。
在其中两例精原细胞瘤(seminoma)中,HLA LOH 仅影响一个 I 类基因;在另外三例中,HLA-A 和 HLA-C 基因受到影响。还有一例中,HLA LOH 可能影响全部三个 HLA 基因,该例是唯一受影响的 NSGCT。
在 GEL-TGCT-0053(一例化疗后淋巴结转移)的样本中,检测到 HLA-A 和 HLA-B 的 LOH;虽然由于检测到两个高度相似的 HLA-C 单倍型(C07:02 和 C07:01),无法确证 HLA-C 的 LOH,但基因排序表明其很可能也发生了 HLA-C 的丢失。
我们未观察到 HLA 纯合性(方法)与诊断年龄、临床分期或病理分期之间存在显著关联。
等位基因不平衡(但未形成 LOH)
在另一 17 例样本中观察到未伴随 LOH 的等位基因不平衡,即由于 HLA 位点不等量的拷贝增益或 LOH 未达到统计学显著性导致的 HLA 不平衡,分布于精原细胞瘤与 NSGCT。
-
在这些病例中,多数为精原细胞瘤(9/17;53%)。
-
其余多数病例的主要组织学类型为胚胎癌(EC)(6/17;35%)。
这提示 TGCT 中可能存在亚型特异的免疫破坏机制。
未观察到 HLA 或 B2M 突变,这类突变可影响新抗原与 MHC 的结合(方法)。在抗原呈递及加工相关基因中筛查体细胞突变(方法)时,发现一例携带 HLA LOH 的精原细胞瘤同时获得了蛋白酶体调控因子 PSME4 的突变,该基因在免疫蛋白酶体活性与免疫肽组多样性中发挥关键作用。
总体而言,这些发现提示,虽然 HLA 突变并非 TGCT 中主要的免疫逃逸机制,但 HLA LOH 可能代表一种免疫破坏或逃逸的途径,主要发生在部分精原细胞瘤中,仍需进一步研究。
新抗原负荷及 HLA LOH 对其影响
TGCT 样本中位拥有 10 个新抗原突变,主要来源于 SNV(补充数据 8)。
我们未发现 HLA LOH、HLA 不平衡或完整 HLA 位点之间的新抗原负荷存在显著差异。进一步分析具有 HLA LOH 的肿瘤是否受到 LOH 事件影响其新抗原景观(补充图 19)。研究团队比较了:
-
预测能结合被丢失的等位基因的抗原肽数量
vs. -
预测能结合保留等位基因的抗原肽数量。
总体上未观察到显著差异,但有 3/6 样本(GEL-TGCT-0007、GEL-TGCT-0018、GEL-TGCT-0050)呈现趋势:与丢失等位基因相关的抗原肽数量更多。
另有 2/6 样本表现相反趋势,但差异较小。
这些结果可能表明:
-
在部分精原细胞瘤中,HLA LOH 可提供实际的免疫选择压力逃逸;
-
而在其他病例中,免疫选择压力可能很弱,或 HLA LOH 只是其他非遗传性免疫逃逸机制的继发事件。
佳学基因评述(Discussion)
据我们所知,本研究提供了迄今为止规模最大的成人 TGCT(睾丸生殖细胞肿瘤)全基因组分析。本研究将已发表的全基因组数量扩大了近十倍,更加明确了分子亚型的基因组基础,并刻画了肿瘤的典型演化轨迹。
我们为 17 个候选驱动基因提供了支持证据,其中包括亚型特异性的驱动基因。此外,我们鉴定到 PTMA 的一处潜在丧失功能型驱动突变,而该基因目前未被 OncoKB 或 COSMIC 癌症基因名录收录。既往研究提示 PTMA 的同源基因 PTMS(parathymosin)可能与 GCT 的表观遗传重塑有关。那些仅在单一 TGCT 队列中被鉴定出的潜在驱动基因,如 GEL 队列中的 KLF4 或 TCGA 中的 FAT4,可能代表罕见或低频率的驱动事件。一项关于儿童和青少年 GCT 的最新研究报告称,FAT 家族基因仅在非精原细胞瘤亚型中发生突变。本研究中检测到的涉及钙黏蛋白基因的复发性缺失及结构变异热点,支持这些蛋白在 TGCT 致癌及进展中可能具有重要作用。支持细胞–生殖细胞黏附对于精子发生至关重要,而钙黏蛋白是睾丸中细胞间黏附的重要介导者。
我们观察到所有参与者中 SBS1 的负荷均低于 SBS5,这可能与队列的年龄分布有关,且部分病例中名义上与“分子时钟”相关的 SBS1 完全缺失。最新观察支持以下假设:正常生精小管中较低的 SBS1 负荷,可能由于精原干细胞相比体细胞干细胞具有更低的分裂速率,同时 SBS1 与 SBS5 的产生速率是独立调控的。此前有观点认为 SBS1 突变可能在 DNA 复制时、也就是细胞有丝分裂时产生。KIT 突变的精原细胞瘤中 SBS1 的贡献减少,可能表明这些细胞处于或曾经处于长期的有丝分裂停滞状态。
此外,我们鉴定出六个散发的 SBS 突变特征。值得注意的是,与长期硫唑嘌呤暴露相关的 SBS32 在约 10% 的参与者中被检测到,尽管没有记录到此类治疗史,提示可能存在其他可导致 SBS32 突变的暴露因素。恶性 GCT 的胎儿起源提示这些暴露甚至可能发生于子宫内。另一种可能性是,不同年龄的暴露或个体对突变损伤的易感性差异,也可能解释精原细胞瘤观察到的双峰发病年龄分布。畸胎瘤亚型是一个终末分化的组织,通常对化疗不敏感。本研究报道的化疗后畸胎瘤中明显缺乏与铂类药物暴露相关的 SBS31 和 SBS35,这提示至少部分原因可能是未分化细胞能够抵抗化疗通常引起的特定突变损伤。我们在成人 TGCT 中报道到 SBS18,且仅出现在 NSGCT 中,可能对应于发育早期由内源性 ROS 机制诱导的损伤。突变特征演化分析提示这些过程在 NSGCT 的发展和进展中保持活跃。重要的是,TGCT 中仍有相当比例的突变特征来源未知,提示仍存在未被识别的突变过程。
在精原细胞瘤中,低水平的肿瘤浸润淋巴细胞(TILs)与较差的患者预后相关,如更高的临床分期及增加的复发率。本研究发现 HLA LOH 几乎仅见于精原细胞瘤,且可能导致抗原肽呈递减少,这提示一种可能的基因组机制,解释 TILs 低的精原细胞瘤亚群。此外,一项近期研究报告 GCT 中 HLA-I LOH 的发生率为 16.7%,与我们的结果基本一致。
TGCT 中基因组事件的时间顺序与大多数肿瘤在性腺发育途径中的起源一致。与 TGCT 经典模型一致,WGD(全基因组加倍)发生在最早阶段,可能源于有丝分裂后期的着丝粒分裂错误,并通常先于 12p 的增益。尽管 TGCT 的其他基本生物学异常已在原位生殖细胞肿瘤(GCNIS)中显现,但 WGD 在这些前驱病变中是否同样频繁,或是否在无临床表现的正常生殖细胞中存在,仍有待确定。概率排序同样支持以下观点:在肿瘤细胞早期四倍化之后的染色体获得与丢失并非随机,而是在典型 TGCT 发育过程中有特定事件被偏好或被抑制。最近对卵巢腺癌的分析提示,尽管 WGD 通常在克隆演化早期发生,但可贯穿女性生殖生命周期出现。然而,在男性生殖组织中,此类事件可能仅限于早期生命阶段。本研究中鉴定出的少数较晚发生 WGD 的肿瘤提示 TGCT 存在少见的病因,这些情况需要在更大队列中进一步研究。
本研究的局限性包括相对较小的样本量,以及队列的临床同质性(早期精原细胞瘤患者比例较高),导致某些亚群分析的样本量有限。更大规模的靶向研究将有助于分析更罕见的 TGCT 亚型、更具侵袭性的疾病类型以及生存结局较差的个体。另一个局限是我们仅考虑了 DNA 这一单一数据模态。尽管我们确定了 TGCT 发病中的潜在驱动因素,但在补充实验中验证这些发现将提高对其可靠性的信心。对多模态数据(如 RNA、蛋白质、DNA 可及性)的分析对于更深入理解 TGCT 的起始与进展机制至关重要。此外,我们的分析未考虑种系变异的潜在致病性,未来研究应予以关注。尽管存在这些局限性,本研究揭示了驱动 TGCT 肿瘤发生与进展的多样基因组过程,并强调了可能促进特定 TGCT 亚型免疫逃逸的重要基因组改变。
-



